
- •№ 16. ПЕПТИДЫ и Белки
- •Пептиды
- •Пептиды
- •Классификация пептидов.
- •Пептиды, названия
- •Электронное строение амидной (пептидной) связи:
- •ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ.
- •Взаимное положение плоскостей пептидных групп в полипептидной цепи
- •Основные функции пептидов:
- •ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
- •Выполняет функцию протектора белков
- •Тафтсин
- •Селанк – первый в мире пептидный анксиолитик с уникальным сочетанием психотропной активности: антидепрессивной,
- •Нейропептиды (опиатные пептиды).
- •Окситоцин (1954) вызывает сокращение
- •Даларгин
- •Применяется Даларгин при обострении язвенной болезни желудка и двенадцатиперстной кишки, ускоряет заживление язвы;
- •Семакс.
- •Пептид АКТГ4-10 («Семакс») обладает
- •Инсулин (от лат. insula — остров)
- •Инсулин
- •шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси). Молекулы удерживают вместе
- •Биолан
- •при стрессе и заболеваниях нервной системы;
- •Принципиальная схема синтеза пептида
- •ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ
- •II.Активация группы –СООН
- •Второй компонент
- •IV. Образование амидной связи
- •Схема твердофазного синтеза полипептидов:
- •Схема твёрдофазного синтеза полипептидов
- •Второй компонент (и дальнейшее наращивание цепи)
- •Функции
- •Функции белков
- •Степень организации белковых молекул
- •Первичная структура пептидов и белков.
- •Белки в медицине.
- •Вторичная структура белков
- •Лайнус Карл Полинг
- •-спираль молекулы
- •-Структура
- •-структура
- •Вторичная структура белков
- •-Поворот
- •Начиная с молекулярной массы примерно 14 — 16 кДа прослеживается тенденция к формированию
- •Полипептидная цепь, включающая элементы той или иной вторичной структуры, способна вся целиком укладываться
- •Третичная структура
- •Цистеин
- •Глобулярные белки
- •РАЗЛИЧНЫЕ ВАРИАНТЫ
- •Фибриллярные белки
- •Коллагеен — фибриллярный белок, составляющий основу
- •Троично-спиральная модель
- •Структура лизоцима (мурамидазы).
- •Сериновая протеаза - трипсин
- •ацилтрансфераза
- •Порины - трансмембранные белки, представляющие собой гидрофильные поры в липофильной мембране
- •Прионы
- •Губчатые энцефалопатии
- •В результате перерождения ткань мозга повреждается с образованием множества небольших полостей, из-за чего
- •*Фолдинг – спонтанное сворачивание белковой
- •Под четвертичной структурой подразумевают способ
- •Четвертичная структура белков
- •Пример четвертичной структуры - вирус табачной мозаики:
- •Гемоглобин выполняет роль переносчика кислорода от лёгких к клеткам
- •Гемоглобин человека
- •Гемоглобин человека
- •Строение белковой молекулы
- •Денатурация белков
- •Денатурированный белок теряет
- •По данным Всемирной организации здравоохранения примерно половина
- •Цветные реакции на белки
- •Спасибо!!!
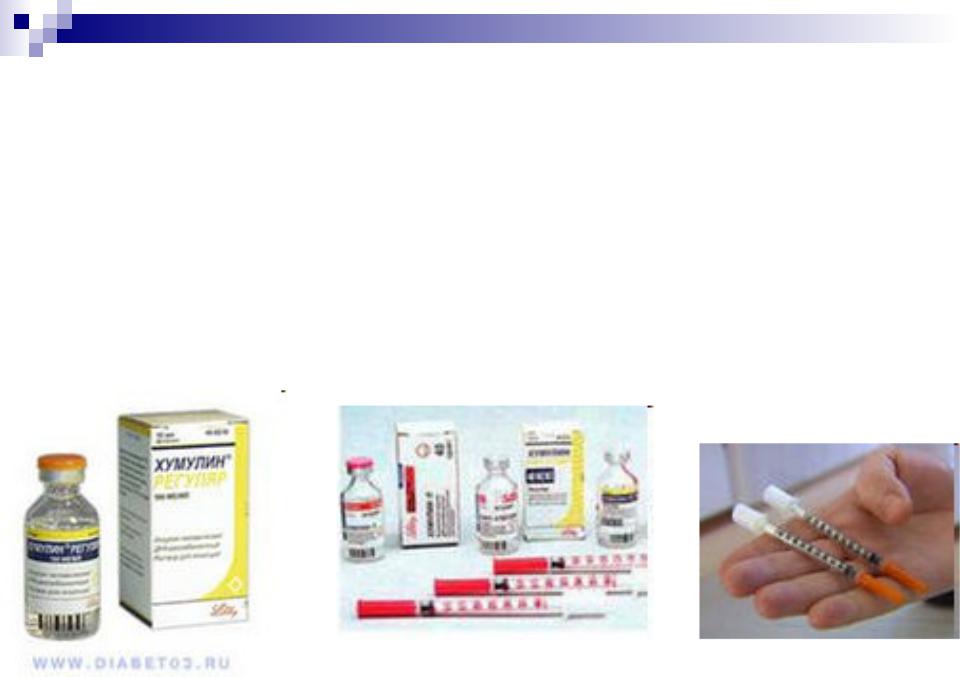
Инсулин (от лат. insula — остров)
— гормон, ответственный за контроль метаболизма углеводов, жиров и белков, вырабатывается
-клетками поджелудочной железы.
Снедостатком инсулина в организме связаны серьезные нарушения углеводного обмена
(сахарный диабет).
21

Инсулин
Цепь А содержит 21, а цепь Б — 30 аминокислотных остатков. Инсулин применяется для лечения сахарного диабета.
22

шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси). Молекулы удерживают вместе остатки гистидина, связанные ионами цинка. Введенный инсулин находится под кожей в виде гексамера, постепенно распадаясь на биологически активные мономеры, поступающие в кровоток.
NPH-инсулины Длительного действия
16-18 час. «Изофан» 23

Биолан
комплекс веществ пептидной группы, природных нейропротекторных аминокислот и пептидов, оптимально сбалансированных и необходимых для нормального и стабильного функционирования нервной системы и организма человека.
- TrpAlaGlyGlyAspAlaSerGlyGlu -
Delta sleep inducng peptide, DSIP
-βAlaHis - карнозин
- Gly |
- глицин |

при стрессе и заболеваниях нервной системы;
при хронической усталости, депрессии, раздражительности, бессоннице;
в экстремальных ситуациях;
для повышения физической и умственной работоспособности;
для улучшения памяти, концентрации внимания, способности к обучению;
для укрепления иммунной системы, повышения сопротивляемости организма;
для ускорения выздоровления после заболеваний;
для повышения адаптационных возможностей организма;
для защиты от стрессов сердечно-сосудистой, дыхательной и эндокринной систем;
для уменьшения побочных явлений химио- и радиотерапии при лечении онкологических заболеваний;
при лечении алкоголизма и наркомании, при отвыкании от курения;
для защиты организма от воздействия экологических загрязнений.
25


 Принципиальная схема синтеза пептида
Принципиальная схема синтеза пептида
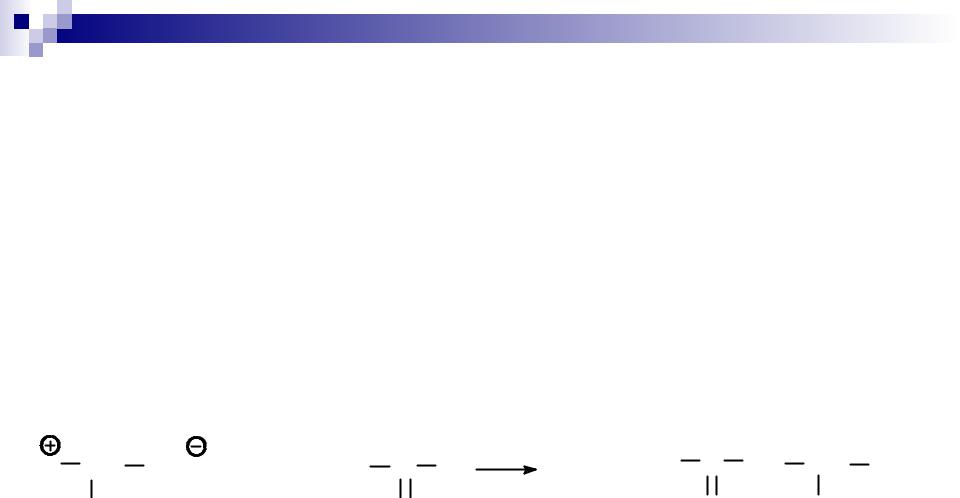
ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ
Схема синтеза дипептида аланил-валина:
Первый компонент – N-концевая аминокислота аланин
I. Защита группы –NH2
2 экв. 1N NaoH
H3N CH COO + C6H5CH2O C Cl |
-HCl |
C6H5CH2O C NH CH COOH |
||||
CH3 |
O |
O |
CH3 |
|||
|
|
|||||
-Аланин |
Карбобензоксихлорид |
Карбобензоксигруппа |
|
|||
Ala |
ZCl |
|
|
Z Ala OH |
||
27

II.Активация группы –СООН
активация СOOH-группы |
этилхлорформиат |
1N NaoH |
|||||
С6H5CH2OCO — NH — |
|
CH — COOH + Cl —C |
— OC2H5 |
||||
|
HCl |
||||||
|
|
|
|||||
Z Ala OH |
|
|
СH3 |
|
|
|
|
|
|
О |
|
||||
С6H5CH2OCO — NH — CH — C — O — C — OC2H5
СH3 |
O |
O |
смешанный ангидрид |
ангидридная связь |
|
Z Ala OC(O)OC2H5
28

Второй компонент
–С-концевая аминокислота валин
III.Защита группы –СООН
|
1 экв.1N NaOH |
NH3 CH COO + C2H5OH |
H+ NH2CHCOOC2H5 |
CH(CH3)2 |
CH(CH3)2 |
Валин |
Этиловый эфир валина |
Val |
Val OEt |
29

IV. Образование амидной связи
Z Ala OC(O)OC2H5 |
Val OEt |
C6H5CH2OCNHCHC
 O COC2H5 + NH2CHCOOC2H5 SN
O COC2H5 + NH2CHCOOC2H5 SN
O H3C O |
O |
CH(CH3)2 |
 C6H5CH2OCNHCHCNHCHCOOC2H5+ CO2 + C2H5OH O H3C O CH(CH3)2
C6H5CH2OCNHCHCNHCHCOOC2H5+ CO2 + C2H5OH O H3C O CH(CH3)2
Z Ala Val OEt
30
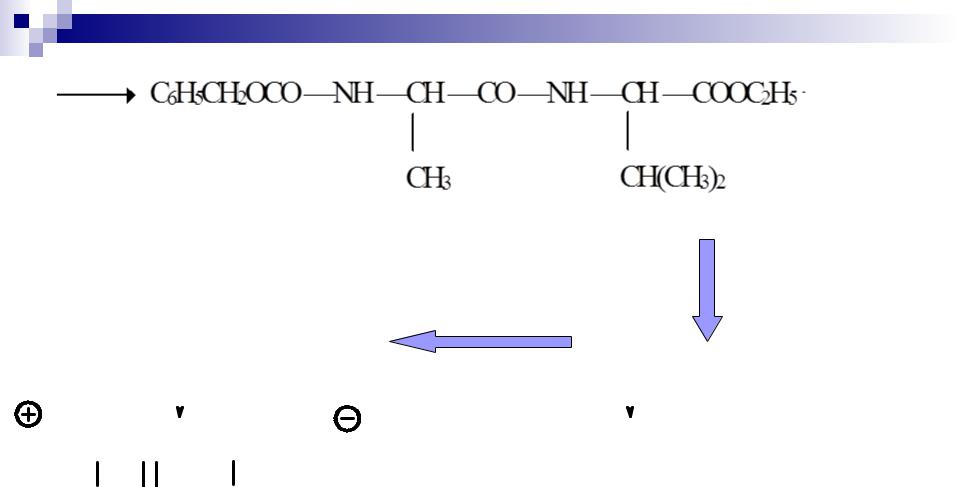
Z Ala Val OEt
H2/Pd |
|
ZAla Val OH |
|
H2O/NaOH |
|
|
NH3CHCNHCHCOO + C6H5CH3 + CO2 + C2H5OOH H3C O CH(CH3)2 Толуол
Аланилвалин
H Ala Val OH
31
