
- •№ 16. ПЕПТИДЫ и Белки
- •Пептиды
- •Пептиды
- •Классификация пептидов.
- •Пептиды, названия
- •Электронное строение амидной (пептидной) связи:
- •ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ.
- •Взаимное положение плоскостей пептидных групп в полипептидной цепи
- •Основные функции пептидов:
- •ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
- •Выполняет функцию протектора белков
- •Тафтсин
- •Селанк – первый в мире пептидный анксиолитик с уникальным сочетанием психотропной активности: антидепрессивной,
- •Нейропептиды (опиатные пептиды).
- •Окситоцин (1954) вызывает сокращение
- •Даларгин
- •Применяется Даларгин при обострении язвенной болезни желудка и двенадцатиперстной кишки, ускоряет заживление язвы;
- •Семакс.
- •Пептид АКТГ4-10 («Семакс») обладает
- •Инсулин (от лат. insula — остров)
- •Инсулин
- •шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси). Молекулы удерживают вместе
- •Биолан
- •при стрессе и заболеваниях нервной системы;
- •Принципиальная схема синтеза пептида
- •ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ
- •II.Активация группы –СООН
- •Второй компонент
- •IV. Образование амидной связи
- •Схема твердофазного синтеза полипептидов:
- •Схема твёрдофазного синтеза полипептидов
- •Второй компонент (и дальнейшее наращивание цепи)
- •Функции
- •Функции белков
- •Степень организации белковых молекул
- •Первичная структура пептидов и белков.
- •Белки в медицине.
- •Вторичная структура белков
- •Лайнус Карл Полинг
- •-спираль молекулы
- •-Структура
- •-структура
- •Вторичная структура белков
- •-Поворот
- •Начиная с молекулярной массы примерно 14 — 16 кДа прослеживается тенденция к формированию
- •Полипептидная цепь, включающая элементы той или иной вторичной структуры, способна вся целиком укладываться
- •Третичная структура
- •Цистеин
- •Глобулярные белки
- •РАЗЛИЧНЫЕ ВАРИАНТЫ
- •Фибриллярные белки
- •Коллагеен — фибриллярный белок, составляющий основу
- •Троично-спиральная модель
- •Структура лизоцима (мурамидазы).
- •Сериновая протеаза - трипсин
- •ацилтрансфераза
- •Порины - трансмембранные белки, представляющие собой гидрофильные поры в липофильной мембране
- •Прионы
- •Губчатые энцефалопатии
- •В результате перерождения ткань мозга повреждается с образованием множества небольших полостей, из-за чего
- •*Фолдинг – спонтанное сворачивание белковой
- •Под четвертичной структурой подразумевают способ
- •Четвертичная структура белков
- •Пример четвертичной структуры - вирус табачной мозаики:
- •Гемоглобин выполняет роль переносчика кислорода от лёгких к клеткам
- •Гемоглобин человека
- •Гемоглобин человека
- •Строение белковой молекулы
- •Денатурация белков
- •Денатурированный белок теряет
- •По данным Всемирной организации здравоохранения примерно половина
- •Цветные реакции на белки
- •Спасибо!!!
№ 16. ПЕПТИДЫ и Белки
Спирали встречаются во многих областях: в архитектуре, в макромолекулах белков, нуклеиновых кислот и даже в полисахаридах (Loretto Chapel, Santa Fe,
NM/© Sarbo )
Пептиды
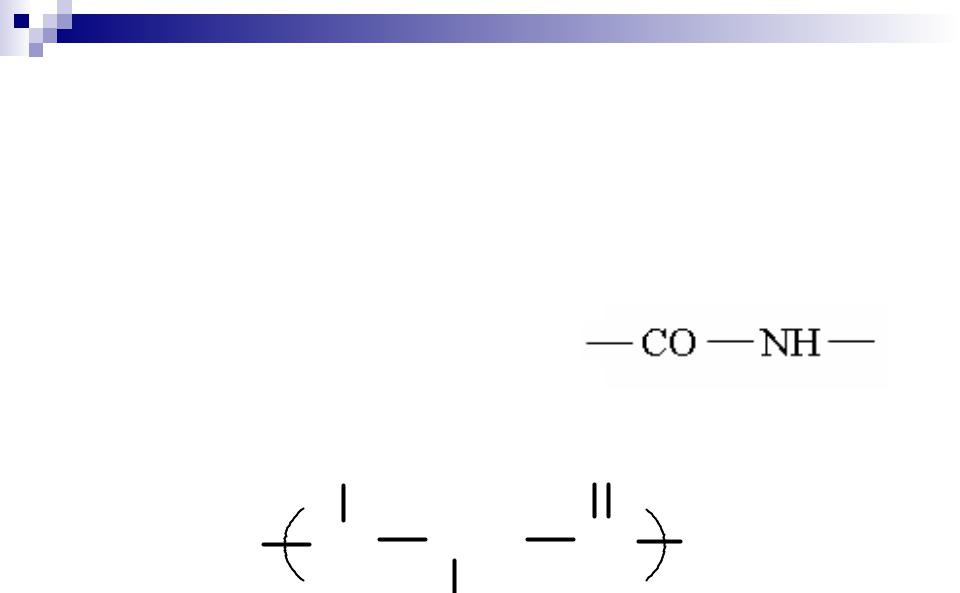
Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных
амидной (пептидной)
H |
O |
N CH |
C |
Rm |
n |
|
2

Пептиды
(греч. Πεπτος, peptós — сваренный, переваренный, питательный).
Термин «пептиды» был предложен известным химиком Эмилем Фишером. Слово образовано из первых четырёх букв названия
пептоны (продукты расщепления белков пепсином) и конечных букв названия углеводов полисахариды.
ФИШЕР (Fischer), Эмиль
9 октября 1852 г. – 15 июля 1919 г. Нобелевская премия по химии, 1902 г.
3

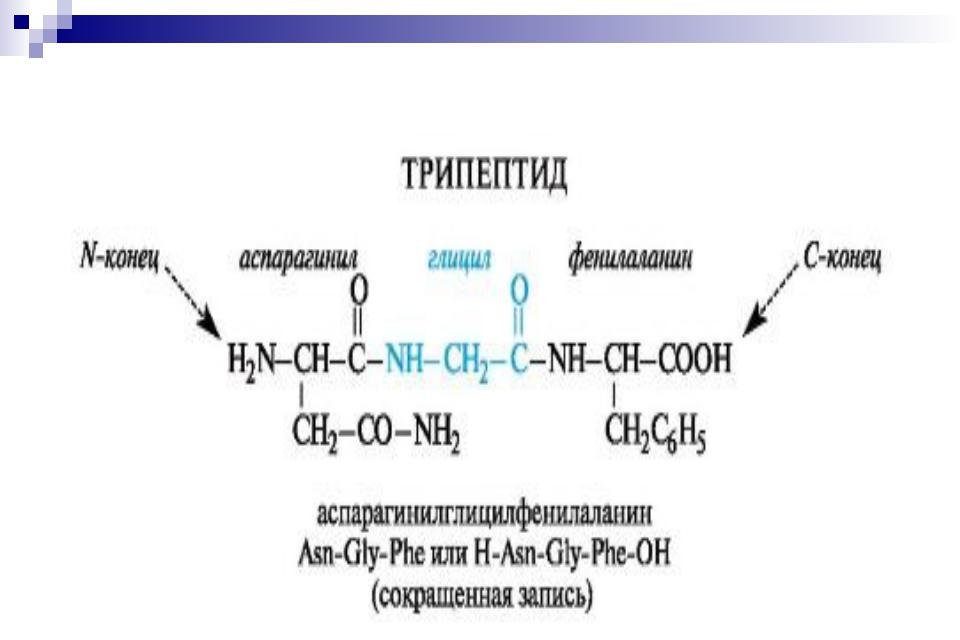
Классификация пептидов.
В зависимости от числа аминокислотных остатков различают ди-, три-, тетра-, пента- и тому подобные пептиды;
пептиды с молекулярной массой не более 10 000 у.е., (т.е. содержащие не более 50-60 аминокислотных остатков) называют олигопептидами,
а с молекулярной массой, большей 10 000 у.е.
полипептидами или белками.
4
Пептиды, названия
NGF
5
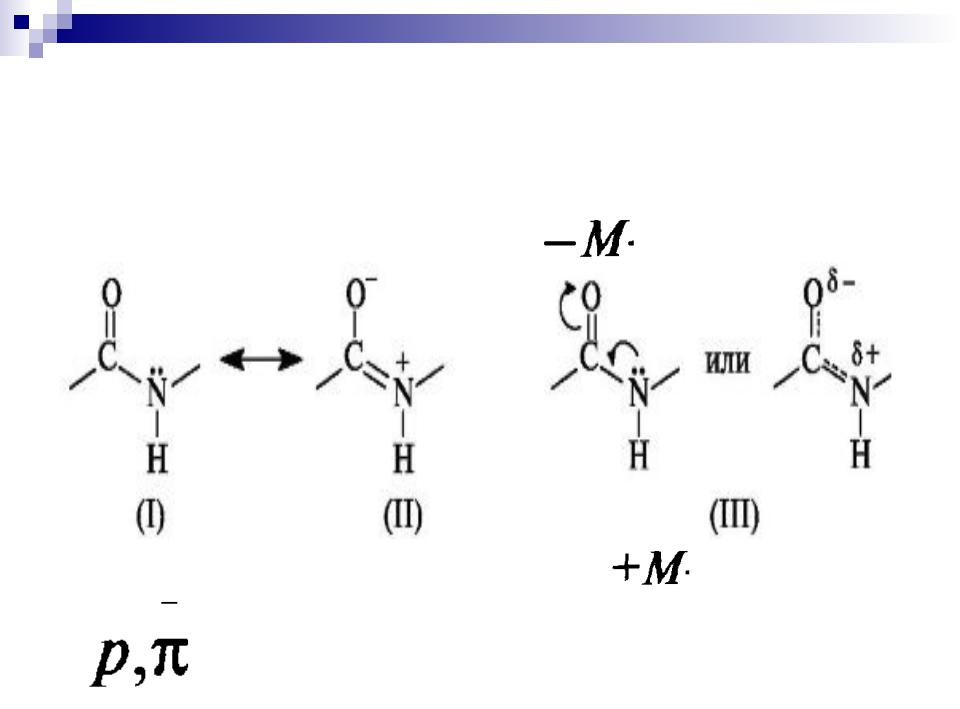
Электронное строение амидной (пептидной) связи:
р- -сопряженная система
6
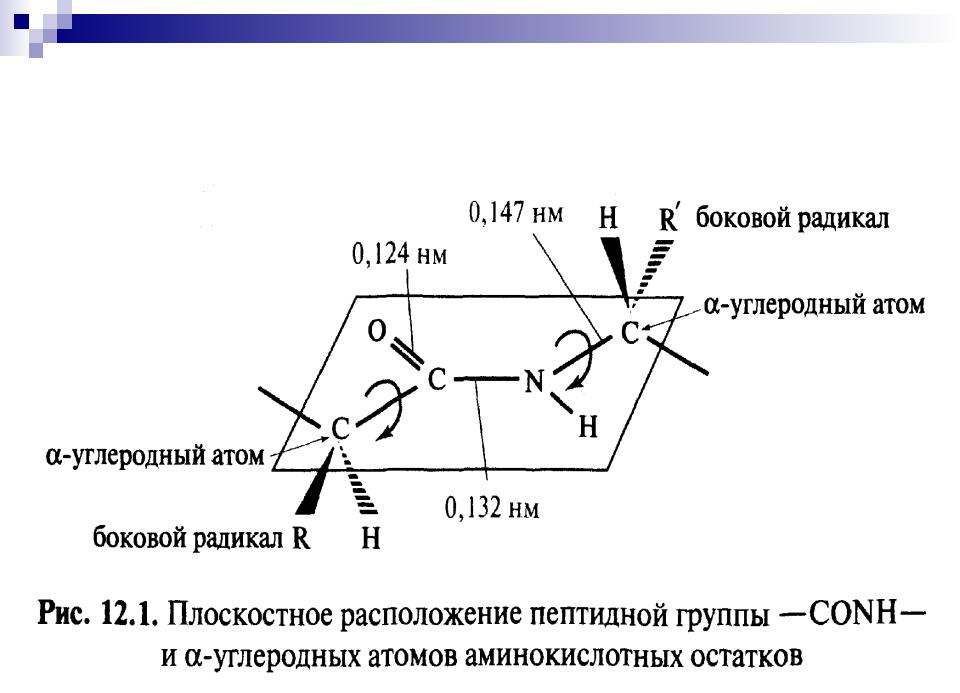
ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ.
С-О |
0,143 нм |
|
|
|
(С=О |
0,121 нм) |
|
||
транс- положение |
|
α |
||
α |
барьер вращения |
|||
|
|
|||
|
|
|
Составляет |
|
|
|
|
63-84 кДж/моль |
|
|
|
C=N |
0,127нм |
|
р- -сопряженная система
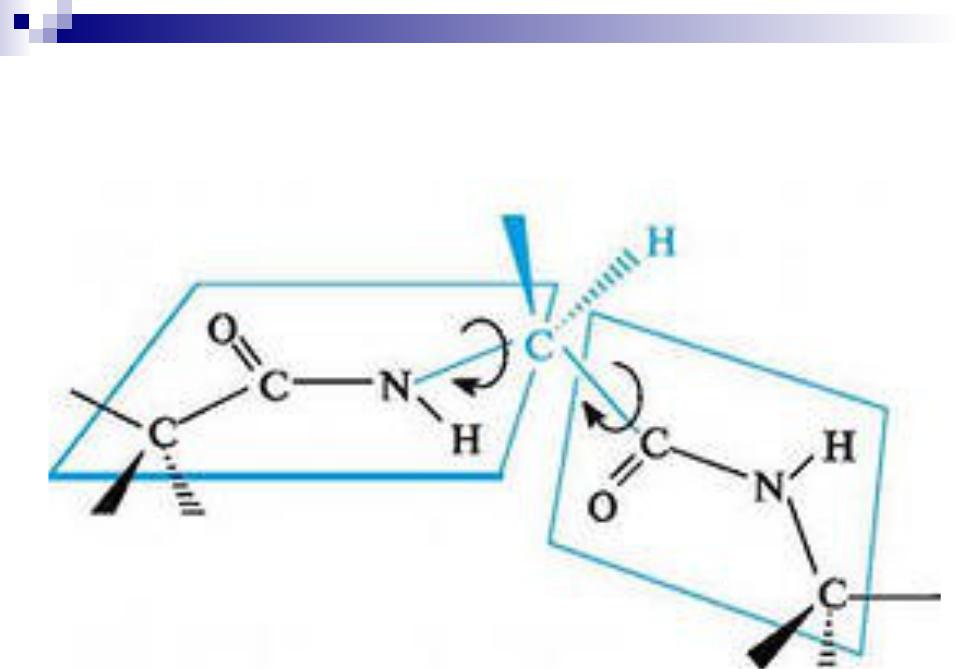
 Взаимное положение плоскостей пептидных групп в полипептидной цепи
Взаимное положение плоскостей пептидных групп в полипептидной цепи
R
α
α |
1080 |
R* |
α |
R**8

Основные функции пептидов:
регуляторная (рилизинг-факторы или либерины, нейромедиаторы);
гормональная (окситоцин, вазопрессин, брадикинин, гастрин и др.);
антибиотическая (грамицидин А, В, С, S; актиномицин D и др.);
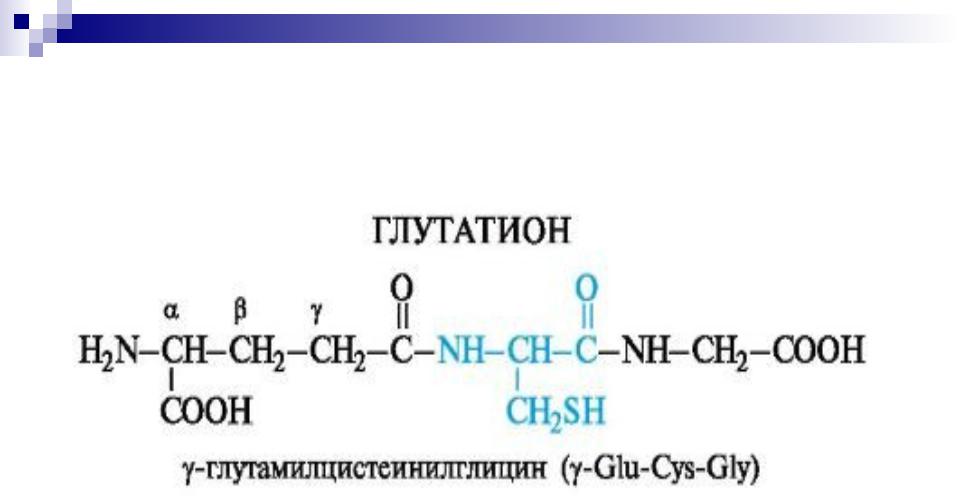
антиоксидантная (глутатион и др.); регуляторы митоза (факторы роста); функция витаминов (фолиевая кислота); пептидные алкалоиды (эрготамин и др.); токсическая (фаллоидин, аманитин и др.).
9
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
10
