
- •Реакции окисления-восстановления
- •Степень окисления атома углерода
- •Окисление
- •Восстановление
- •Окисление органического соединения
- •(97 ккал/моль)
- •Увеличение способности к окислению:
- •Связи С С в насыщенных соединениях окисляются
- •Окисление связей С-Н
- •Связи С–Н при насыщенных атомах
- •Окисление в мягких условиях ( в условиях организма) :
- •Ферментативное гидроксилирование соединений со связью С-Н
- •Коферменты: функции
- •Окисление двойных углерод-углеродных связей
- •Жёсткие условия
- •а) окисление боковой цепи
- •б) окисление ароматического кольца
- •Способность к окислению заметно увеличивается
- •Полиядерные арены способны окисляться и
- •Окисление спиртов
- •Дегидрирование спиртов над
- •Биологическое дегидрирование
- •Никотинамидадениндинуклеотид
- •Дегидрирование спирта в альдегид или кетон
- •Окисление ретинола в ретиналь
- •Акцептор 2 атомов Н
- •б) окисление спиртов сильными окислителями
- •Окисление альдегидов
- •Окисление кетонов
- •Окисление фенолов
- •хиноны
- •Система хинон-гидрохинон участвует в процессе
- •Тиолы
- •Тиолы
- •Сульфиды
- •Окисление аминов
- •Восстановление органических соединений
- •Каталитическое гидрирование
- •транс - присоединение
- •2. Некаталитическое гидрирование
- •Восстановление нафталина происходит ступенчато:
- •Восстановление карбонильных соединений:
- •3. Биохимическое восстановление
- •Никотинамидадениндинуклеотид
- •ОТТО ГЕНРИХ ВАРБУРГ
- •окисленная форма кофермента
- •восстановленная форма кофермента
- •Витамин В3, витамин РР, ниацин
- •Характерные симптомы пеллагры –
- •четвертичная соль никотинамида
- •Процесс протекает стереоселективно :
- •Флавинадениндинуклеотид
- •Флавинадениндинуклеотид.
- •ФАД выполняет роль окислителя
- •Витамин В2
- •Источники:
- •Последствия дефицита:
- •Система переноса электронов с помощью гидрид-ионов
- •Кофермент Q (Coenzyme Q10)
- •Система переноса электронов с помощью гидрид-ионов
- •Функции в организме:
- •Богатые источники CoQ10
- •Спасибо

№ 12.
Реакции окисления и восстановления
органических соединений

Реакции окисления-восстановления
реакции, в ходе которых происходит
изменение степени окисления одного или нескольких атомов углерода.
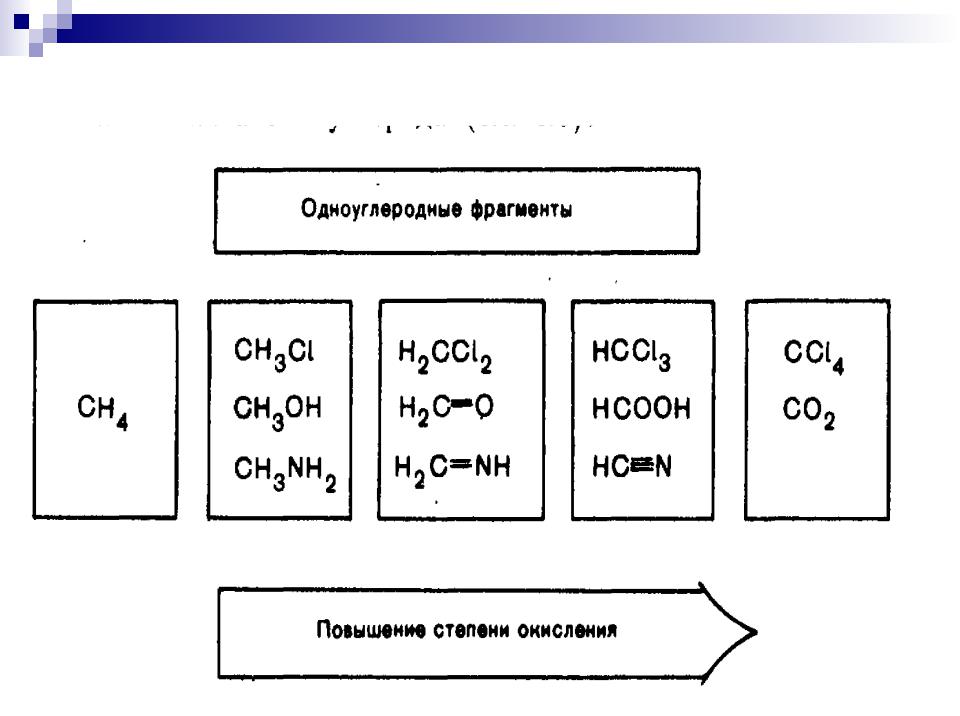
Степень окисления атома углерода
4 |
( 3)+(+1)= - 2 |
( 2)+(+2)= 0 |
( 1)+(+3)= +2 |
+4 |

Окисление
Процесс удаления водорода
образование кратной связи или
замена связей С Н на связи с другими более
ЭО элементами
Окисление – процесс перехода электронов от субстрата к реагенту-окислителю, «потеря электронов» атомом углерода
(степень окисления С увеличивается)

Восстановление
замена связей с электроотрицательными элементами на новые связи С Н.
Восстановление – процесс перехода электронов от восстановителя к органическому субстрату.
- «приобретение электронов» атомом углерода
степень окисления С уменьшается.

Окисление органического соединения
протекает тем легче, чем больше выражена в нём тенденция к передаче электронов.

(97 ккал/моль) |
(94 ккал/моль) (91 ккал/моль) . |
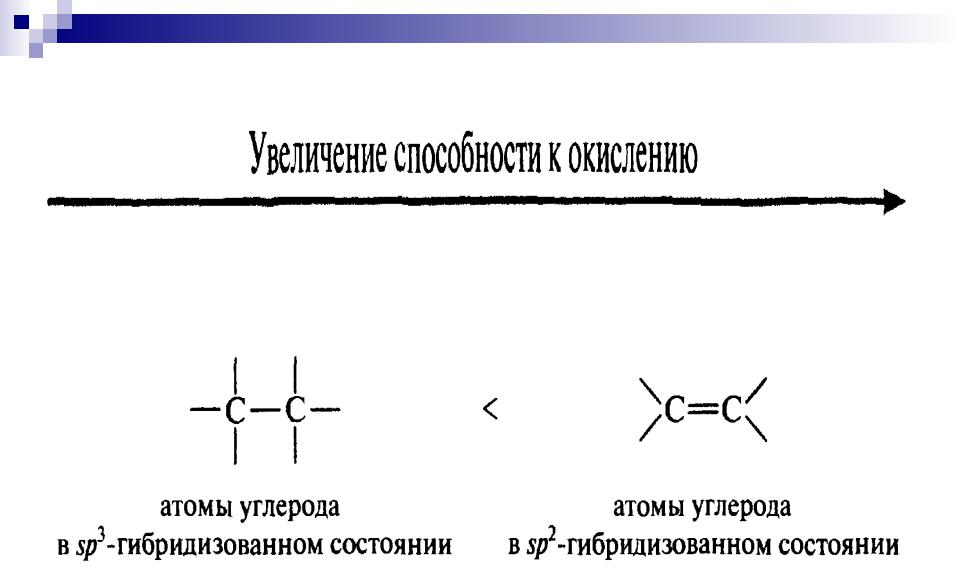

Увеличение способности к окислению:
R H < R OH < R-NH2 ;
Алканы Спирты Амины

Связи С С в насыщенных соединениях окисляются
сбольшим трудом и всегда с разрушением соединения.
Горение алканов
СН4 + О2 СО2 + H2О + выделение тепла и света
Окисление алканов сильными окислителями
RH + K2Cr2O7 + H2SO4, нагревание Смесь
карбоновых кислот

Окисление связей С-Н


