
- •№ 5. Общие закономерности реакционной способности органических соединений как химическая основа их биологического
- •Радикальное замещение у насыщенного атома углерода.
- •Алифатические углеводороды
- •Алканы
- •Алканы
- •Алканы
- •Строение алканов
- •Алканы
- •Алканы. Номенклатура.
- •Алканы. Номенклатура
- •Алканы. Номенклатура
- •Алканы. Номенклатура
- •Алканы. Номенклатура
- •Алканы. Номенклатура
- •Алканы. Номенклатура
- •Алканы. Номенклатура
- •Алканы. Способы получения
- •ВЮРЦ (Wurtz), Шарль Адольф
- •Алканы. Способы получения
- •Алканы. Способы получения
- •Электролиз солей щелочных металлов и карбоновых кислот (реакция Кольбе)
- •Адольф Вильгельм Герман Кольбе Adolph Wilhelm Hermann Kolbe
- •Реакция электролиза по Кольбе:
- •Алканы. Способы получения
- •Химические свойства.
- •Алканы. Химические свойства
- •• Механизм радикального замещения (SR)
- •Алканы. Химические свойства
- •1.Галогенирование начинается только под действием
- •II.Рост цепи
- •Алканы. Химические свойства
- •Алканы. Химические свойства
- •Региоселективность реакции - предпочтительное
- •Селективность реакции SR объясняется :
- ••2. образованием наиболее стабильного промежуточного свободного радикала
- •На результат реакции SR оказывают влияние и электронные эффекты тех заместителей,
- •Хлорирование в аллильное положение ,SR
- •При хлорировании толуола :
- •Избирательное замещение в-положение (аллильное положение) к двойной связи:
- •Алканы. Химические свойства
- •Алканы. Химические свойства
- •Алканы. Химические свойства
- •Реакция автоокисления (реакция
- ••Реакция свободных радикалов с веществами, обладающими повышенной электронной плотностью (фенолы, хиноны, иод, дифениламин
- •-токоферол (витамин Е),
- •Спасибо

Алканы. Химические свойства
2. Нитрование
|
CH |
|
|
|
|
CH3 |
||||
|
|
3 |
|
|
|
140°C |
CH3CH2 |
|
CCH2CH3 + H2O |
|
CH CH |
CHCH CH |
+ HNO |
|
|||||||
|
||||||||||
3 |
2 |
|
2 |
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
||
3-метилпентан |
|
|
|
|
3-метил-3-нитропентан |
|||||
|
|
|
|
|
|
|
||||
обработка 10 – 20 %-ной азотной кислотой в паровой фазе при температуре не выше 140 °С.
Реакция М.И. Коновалова
42

Алканы. Химические свойства
3. Сульфохлорирование
hν
RH + Cl2 + SO2 → RSO2Cl + HCl .
Втор.С > перв.С
С10H22 + SO2 + Cl2 C10H21SO2Cl + HCl
декан |
сульфохлорид |
|
декана |
C10H21SO2Cl + 2NaOH C10H21SO3Na + NaCl + H2O
алкилсульфонат
43
Алканы. Химические свойства
Окисление
Сильные окислители (KMnO4, K2Cr2O7 и др.)
|
|
|
|
|
|
|
[O] |
|
R |
|
|
|
CH2OH |
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
R |
|
CH2 |
|
CH2 |
|
R |
|
|
R |
|
|
|
C H |
||
|
|
|
катализатор |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
R |
|
|
COOH |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
CH CH CH CH |
O2, t |
2CH3COOH + H2O |
|||
|
|||||
3 |
2 |
2 |
3 |
kat |
|
|
|
|
|
|
|
44

Реакция автоокисления (реакция
органических соединений с кислородом воздуха в мягких условиях).
1. R3C H + •O O• |
R3C• + H O O• ; |
• R3C• + •O O• R3C O O• |
|
Образование перекисного радикала (малая р/с)
2. R3C O O• + H CR3 R3C O OH + R3C•
•. Рост цепи гидропероксид
Реакции автоокисления региоселективны
45
Трет.Н < аллил.Н < бензил.Н

•Реакция свободных радикалов с веществами, обладающими повышенной электронной плотностью (фенолы, хиноны, иод, дифениламин - ингибиторы цепных реакций:
OH |
O |
|
O |
|
+ Cl |
|
+ HCl |
Димеризация |
|
|
|
|
||
|
Арилокси |
|
Делокализация сво- |
|
|
радикал |
|
бодного электрона |
|
O |
H |
|
OH |
|
O |
HO |
. |
||
|
H |
4,4'-Диоксидифенил |
||
|
|
|
||
46
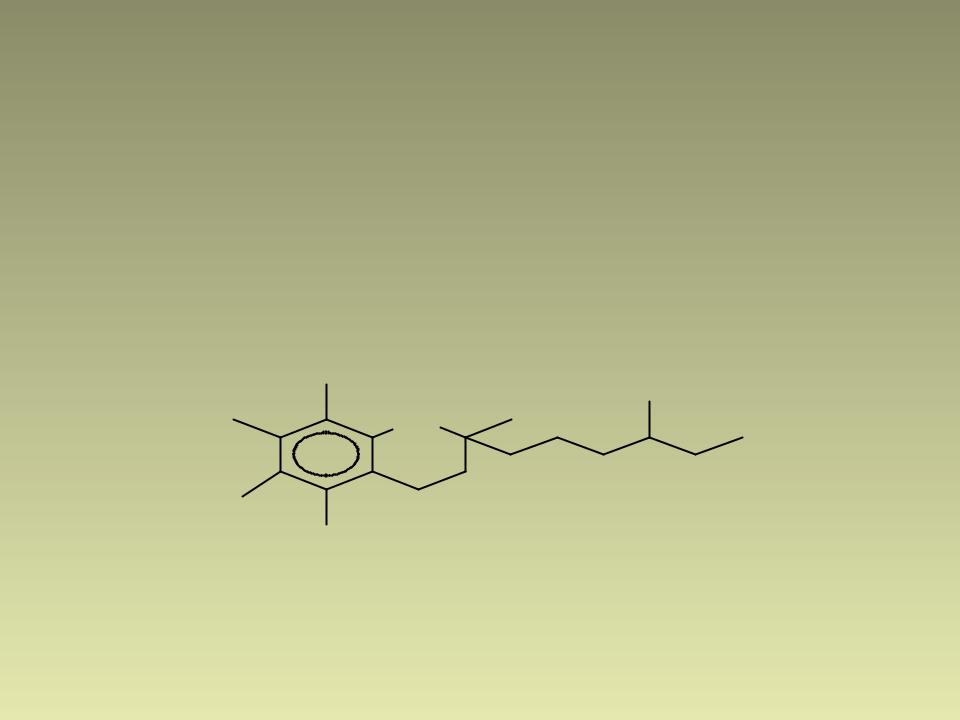
-токоферол (витамин Е),
антиоксидант:
H3C |
CH3 |
CH3 |
|
O |
) H . |
||
|
|
( |
|
|
|
|
3 |
HO |
CH3 |
Âè òàì è í Å |
|
|
|||
47

Спасибо
за Ваше внимание!
48
