
- •РАЗДЕЛ 3
- •Вид используемого электромагнитного излучения
- •20.3.3. Практическое применение
- •Фотометрические реакции
- •Дифференциальная (разностная) фотометрия
- •Производная спектрофотометрия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ИК-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •Природа вещества
- •Способы получения хроматограммы
- •Хроматографические характеристики, используемые для идентификации веществ (характеристики удерживания)
- •Хроматографические характеристики, используемые для количественного определения веществ
- •Хроматографическая колонка
- •Детекторы
- •Табл. 23.1
- •Характеристика некоторых газохроматографических детекторов
- •ГЛАВА 24
- •24.2.1. Методика получения плоскостной хроматограммы
- •Способы получения плоскостных хроматограмм
- •Некоторые реагенты-проявители, используемые в
- •плоскостной хроматографии
- •Неподвижные и подвижные фазы
- •Ионообменное равновесие
- •ГЛАВА 25
- •Табл. 25.1.
- •Табл. 25.2
- •ГЛАВА 26
- •26.1.5. Потенциометрическое титрование
- •ГЛАВА 27
- •Некоторые современные разновидности вольтамперометрии
- •Предисловие ...................................................................................
- •9.2. Жидкость-жидкостная экстракция ...........................................................
- •9.2.5. Применение экстракции .........................................................................
- •23.1. Общая характеристика .............................................................................
- •Литература .....................................................................................
|
|
|
|
|
|
Раздел 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метод настройки |
|
|
|
|
|
|
|
|
|
|
|
|
метод градуировочного графика |
|
E |
|
|
||||
|
|
|
|
|
|
||||||
|
|
прибора |
|
|
|
|
|
|
|||
|
|
|
|
|
Измеряют потенциал электрода при |
|
|
|
|||
|
|
Перед началом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нескольких известных концентрациях |
|
|
|
|
|
|
|
|
работы прибор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
определяемого иона и постоянной ионной |
|
|
|
|
|
|
|
|
(иономер) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
силе раствора, а затем при неизвестной |
|
сильный |
|
|
||
|
|
градуируют с |
|
|
|
|
|
|
|||
|
|
|
|
|
его концентрации и такой же ионной силе |
|
|
|
|||
|
|
помощью |
|
|
|
|
электролит |
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
двух (одного) |
|
|
|
Методырасчёта концентрации |
|
I = const |
|
|
|
|
|
стандартных |
|
|
|
вещества вионометрии |
|
|
lgC |
|
|
|
|
растворов |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
метод концентрационного элемента
Измеряют разность потенциалов двух идентичных ИСЭ, один из которых находится в растворе с известной концентрацией определяемого иона, а второй - в анализируемом растворе
E = |
RT |
lnCст |
Cx = |
|
nF |
||||
|
Cx |
|
метод добавок
Измеряют потенциал электрода в анализируемом растворе и после введения известного объёма стандартного раствора
CстVст |
|
n(E2-E1) |
|
|
Vx |
-1 |
|||
- |
- |
|
|
|
|||||
|
|
10 |
0,059 |
|
|
|
|
|
|
V + V |
|
V |
x |
+ V |
ст |
||||
x ст |
|
|
|
|
|
||||
26.1.5. Потенциометрическое титрование
Потенциометрическим титрованием называется метод анали-
за, основанный на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом.
В основе потенциометрического титрования могут лежать различные протолитические, окислительно-восстановительные, осадительные реакции и реакции комплексообразования, протекающие количественно, стехиометрично и с приемлемой скоростью. Выбор индикаторного электрода для выполнения потенциометрического титрования зависит от используемой реакции. Например, при кислотноосновном титровании обычно используют стеклянный рНчувствительный электрод, при окислительно-восстановительном может быть использован инертный платиновый электрод, при комплексонометрическом – электрод, чувствительный по отношению к ионам определяемого металла и т.д.
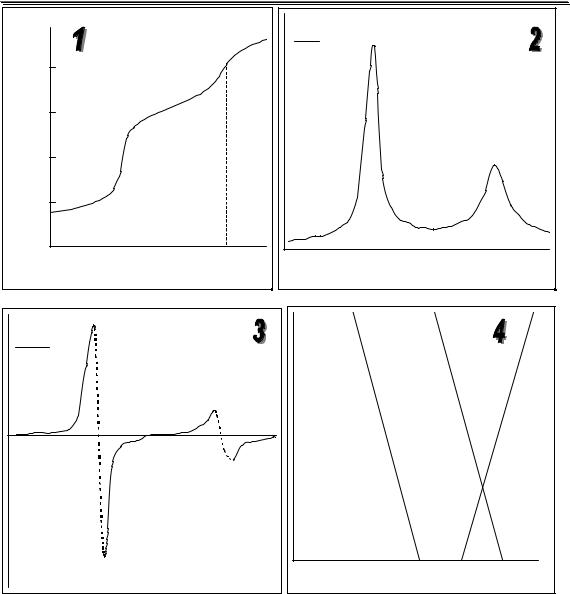
Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана. На рис. 26.3 показаны различные варианты обнаружения конечной точки титрования фосфорной кислоты гидроксидом натрия. Конечной точке титрования на исходной кривой титрования соответствует точка максимального наклона (точка перегиба) кривой, на её первой производной – точка максимума, второй производной – точка пересечения прямой, соединяющей две ветви кривой, с осью абсцисс. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.
332
Инструментальные методы анализа
pH |
9 |
7 |
5 |
3 |
1 |
V(NaOH) |
|
pH |
V2 |
V(NaOH) |
pH
V
V(NaOH)
V
pH
V(NaOH)
Рис. 26.3. Кривая потенциометрического титрования фосфорной кислоты (1), её первая (2) и вторая (3) производные, а также обнаружение конечных точек титрования методом Грана (4).
Преимущества потенциометрического титрования перед титрованием с визуальным обнаружением конечной точки титрования заключаются в том, что:
отсутствует субъективная ошибка обнаружения конечной точки титрования
определение веществ может проводиться в окрашенных и мутных растворах;
имеется возможность дифференцированного титрования компонентов смеси (в особенности, при использовании неводного титрования);
возможна автоматизации процесса титрования.
333
Раздел 3
26.2. Кулонометрический метод анализа
Кулонометрическими называют электрохимические методы анализа, основанные на измерении количества электричества, прошедшего через электролитическую ячейку при электрохимическом окислении или восстановлении вещества на рабочем электроде.
26.2.1. Общая характеристика и классификация
Кулонометрия – это безэталонный метод анализа. Массу оп-
ределяемого вещества при кулонометрических определениях рассчитывают непосредственно из величины аналитического сигнала. В основе кулонометрии лежат законы Фарадея для электролиза. Матема-
тическое выражение объединённого закона Фарадея имеет вид m nFM Q
где m – масса вещества, окисленного (восстановленного) в процессе электролиза; M – молярная масса вещества; n – число электронов, участвующих в электродной
реакции; F – постоянная Фарадея (F = 96487 Кл/моль 9,65 104 Кл/моль), Q – количество электричества, Кл.
При проведении кулонометрических определений необходимо, чтобы:
отсутствовали побочные химические и электрохимические процессы, и выход по току был равен 100%;
определяемый элемент окислялся (восстанавливался) только до одной точно известной степени окисления;
был известен способ определения количества электричества или момента завершения реакции.
потенциостатическая |
|
гальваностатическая |
|
|
|
E = const |
|
|
условияизмерения |
|
|
I = const |
||||||
|
|
|
|
|
|
определяемое |
||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
вещество |
|||
определяемое |
|
|
|
|
|
|
непосредственно |
|||||
|
КУЛОНОМЕТРИЯ |
|
||||||||||
|
|
не участвует в |
||||||||||
вещество |
|
|
|
|
|
|
электродной |
|||||
|
|
|
|
|
|
|||||||
реагирует |
|
|
|
|
|
|
реакции, но |
|||||
непосредственно |
практическое применение |
взаимодействует |
||||||||||
на поверхности |
с продуктом |
|||||||||||
электрода |
|
|
|
|
|
|
электролиза |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
прямая |
|
|
|
|
|
кулонометрическое |
||||||
|
|
|
|
|
|
|
|
|
титрование |
|||
обычно приE = const |
обычно приI= const |
|||||||||||
334
Инструментальные методы анализа
26.2.2. Прямая кулонометрия
Прямые кулонометрические определения обычно проводят при постоянном потенциале.
Прямая кулонометрия при постоянной силе тока используется в тех случаях, когда определяемое вещество находится на поверхности электрода или предварительно выделено на этой поверхности.
Принципиальная схема установки для потенциостатических кулонометрических определений показана на рис. 26.4.
потенциометр
устройство для измерения Q
V |
2 |
|
|
1 |
3 |
ячейка
Рис. 26.4. Принципиальная схема установки для потенциостатических кулонометрических определений
1)рабочий электрод;
2)электрод сравнения;
3)вспомогательный электрод
Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону (рис. 26.5):
It I0e kt |
|
|
I010 k t |
||
k 2,303k |
SD |
|
V |
||
где S – площадь поверхности электрода,
D – коэффициент диффузии электроак-
тивного вещества; V – объём раствора в ячейке; - толщина диффузионного слоя.
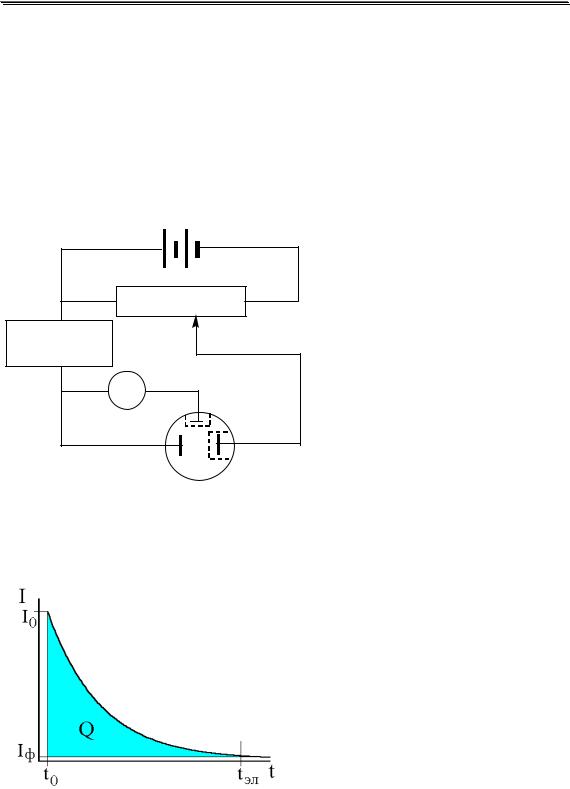
Для того чтобы электрохимическая реакция прошла до конца, теоретически требуется беско-
нечно большое время. Практически при проведении электролиза всегда остаётся некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным,
335
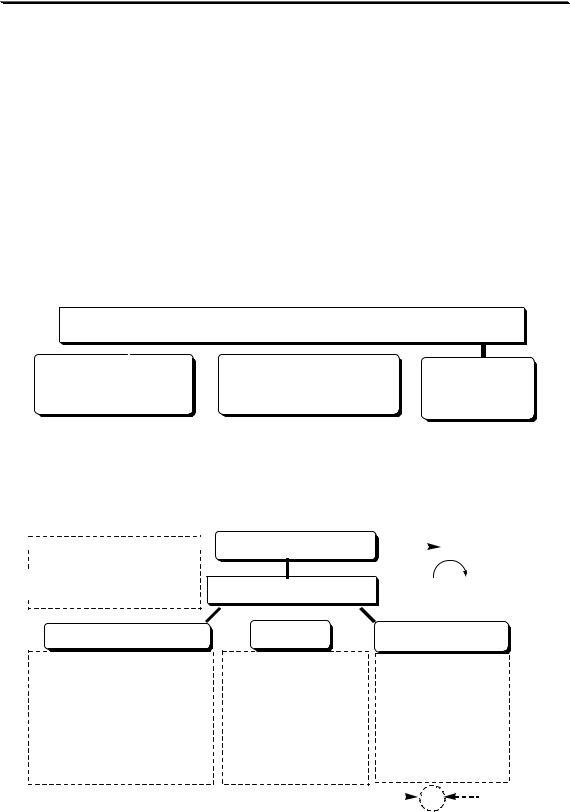
Раздел 3
когда сила тока станет равной 0,01 – 0,001 от первоначального значения. Для ускорения процесса электролиза необходимо создать такие условия, чтобы величина k в зависимости I от t была как можно большей. Для этого используют рабочий электрод с большой площадью поверхности, берут малый объём раствора и, кроме того, раствор в
ячейке постоянно перемешивают (это приводит к уменьшению ). Количество электричества, затраченное на электрохимическое
превращение вещества, в потенциостатической кулонометрии равно:
tэл
Q Qобщ Qф Idt Iфt
t0
Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы:
ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА ЭЛЕКТРИЧЕСТВА
|
|
с помощью |
|
химического |
с помощью |
|
|||
интегратораэлектронноготока |
интегратора тока |
|||
("кулонометра") |
||||
как площадь под кривой "ток-время"
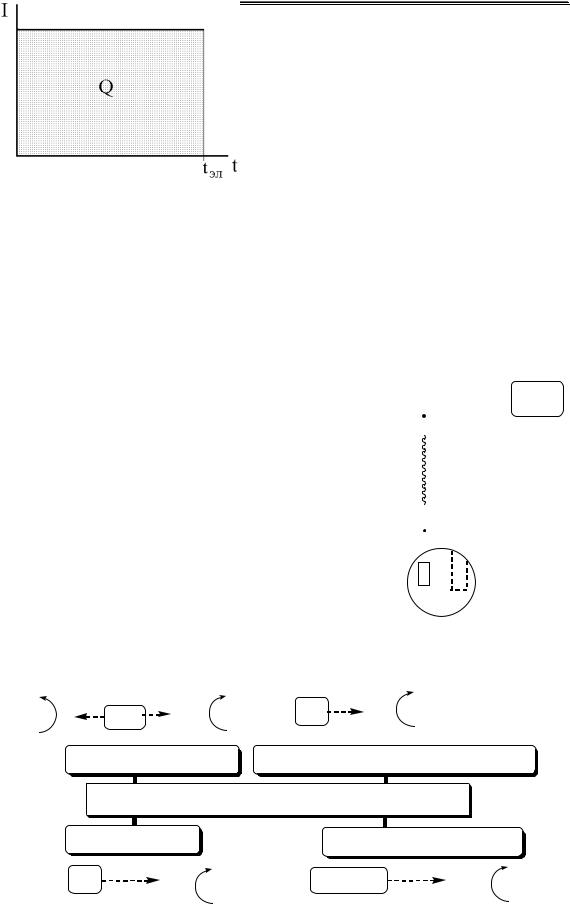
Кулонометром называется электролитическая ячейка, подключаемая последовательно с кулонометрической ячейкой, в которой при замыкании электрической цепи со 100% выходом по току протекает электрохимическая реакция известной стехиометрии.
 Количество электричества
Количество электричества
определяют по
 оптической плотности
оптической плотности  окрашенного раствора
окрашенного раствора
фотометрические I- |
|
I2 |
|
КУЛОНОМЕТРЫ крахмал синее
окрашивание
|
|
|
|
|
|
|
гравиметрические |
газовые |
|
титрационные |
|||
Cостоят и Pt-анода и |
Количество |
Количество |
|
|||
катода, изготовленного |
электричества |
электричества |
|
|||
из металла (Ag, Cu), |
определяют по |
|
определяют |
|
||
ионы которого |
объёму газа, |
путём титрования |
||||
находятся в растворе. |
выделившегося при |
продукта |
|
|||
Количество электричества |
электролизе, |
электродной |
|
|||
определяют по увеличению |
например, при |
реакции |
|
|||
массы катода |
электролизе воды |
I- |
|
|
|
|
1Кл = 1,118 мгAg |
1Кл = 0,1791 см3 (н.у.) |
|
I2 |
Na2S2O3 |
||
|
||||||
1Кл = 0,3295 мгCu |
смеси H2 и O2 |
|
|
|
|
|
Прямая кулонометрия используется для определения соединений Cu, Au, Ag, Tl, Sb и других элементов, а также для хинонов и гидрохинонов, многоатомных фенолов, нитро-, нитрозо- и азосоединений, галогенопроизводных и т.д.
336
Инструментальные методы анализа
26.2.3. Кулонометрическое титрование
В кулонометрическом титровании аналитическим сигналом является не объём стандартного раствора титранта, а количество электричества, которое необходимо для его получения. Кулонометрическое титрование, в отличие от
|
|
|
|
прямой кулонометрии, используется |
||||||||||
|
|
|
|
для определения электронеактивных |
||||||||||
|
|
|
|
веществ. Измерения в кулонометри- |
||||||||||
|
|
|
|
ческом титровании проводятся при |
||||||||||
|
|
|
|
постоянной силе тока. Количество |
||||||||||
|
|
|
|
электричества при таком режиме из- |
||||||||||
|
|
|
|
мерения равно произведению силы |
||||||||||
|
|
|
|
тока на время электролиза (рис. 26.6). |
||||||||||
Рис. 26.6. Зависимость I от t в галь- |
Схема |
|
установки для кулоно- |
|||||||||||
ваностатической кулонометрии |
|
метрического титрования приведена |
||||||||||||
|
|
|
|
на рис. 26.7. |
|
|
|
|
|
|
|
|
|
|
Рис. 26.7. Принципиальная схема установ- |
|
|
|
|
3 |
|
|
|||||||
ки для кулонометрического титрования |
|
|
|
|
|
|
|
|
|
4 |
||||
|
|
|
|
|
|
|
|
|
||||||
1) устройство для измерения разности потенциа- |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
лов; 2) сопротивление; 3) источник постоянного |
|
|
|
|
|
|
|
|
|
|
||||
тока; 4) хронометр; 5) рабочий электрод; 6) вспо- |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
могательный электрод |
|
|
|
|
1 |
|
2 |
|
|
|
|
|||
Рабочий электрод изготовлен, как правило, |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||
из платины, золота, ртути (для катодных про- |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
цессов). Вспомогательный электрод – платиновая |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
проволока, реже – графит. Вспомогательный |
|
|
|
|
|
|
|
6 |
|
|
||||
электрод обычно отделяют от раствора диа- |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
фрагмой, изготовленной из пористого стекла или |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
5 |
|
|
|
|
|
|||||
пластмассы. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
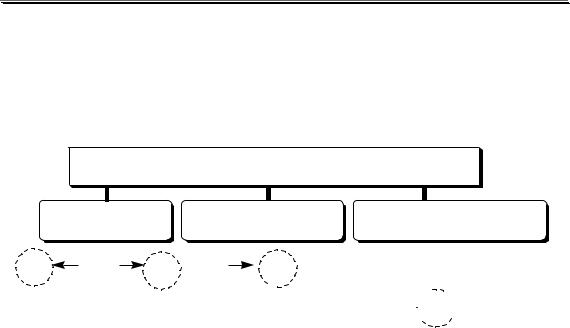
В основе кулонометрического титрования могут лежать различ- |
||||||||||||||
ные типы химических реакций. |
|
|
|
|
|
|
|
|
|
|
|
|||
BH+ |
|
OH- |
A- |
|
Br2 |
2,4,6-трибромфенол |
||||||||
H+ |
H2O |
HA |
Br- |
фенол |
||||||||||
B |
|
|
|
|
|
|
|
|||||||
кислотно-основное окислительно-восстановительное
КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ осадительное комплексометрическое
Ag |
Ag+ AgBr |
HgNH3Y2- |
HY3- |
ZnY2- |
|
Zn2+ |
|||||
|
Br- |
|
|
337
Раздел 3
Титрант в кулонометрическом титровании обычно получают в электролитической ячейке в результате электрохимической реакции, протекающей на рабочем электроде (внутренняя генерация титранта). Если это по той или иной причине невозможно, электрогенерацию титранта проводят в специальном устройстве, находящемся вне ячейки (внешняя генерация титранта).
ИСТОЧНИКИ ПОЛУЧЕНИЯ ТИТРАНТА
|
растворитель |
материал электрода вспомогательныйреагент |
||
+ |
H2O |
OH- Ag |
Ag+ |
добавляют в избытке для |
H |
обеспечения 100% выхода по току |
|||
I- 

 I2
I2 

Конечную точку кулонометрического титрования обнаруживают так же, как и в других титриметрических методах анализа: визуально с помощью индикатора или инструментальными методами (потенциометрически, амперометрически, фотометрически и др.).
Перед проведением титрования обычно проводят предварительное титрование (предэлектролиз). При этом генерируют небольшое количество титранта, необходимое для достижения конечной точки титрования фонового раствора. Цель предварительного титрования – удаление возможных примесей посторонних веществ и устранение погрешности, связанной с состоянием поверхности рабочего электрода.
Преимущества кулонометрического титрования перед дру-
гими титриметрическими методами анализа заключаются в том что:
титрант не нужно готовить, стандартизировать и хранить;
можно получать титранты (например, Fe2+ или Cl2), которые сложно или невозможно приготовить обычным способом;
титрант легче «дозируется» (отрегулировать силу тока значительно легче, чем добавить точный объём титранта);
раствор в процессе титрования не разбавляется;
в процессе предэлектролиза можно устранить мешающее влияние примесей;
одну и ту же ячейку можно использовать для любого вида титрования;
процесс анализа можно легко автоматизировать.
338
