
- •РАЗДЕЛ 3
- •Вид используемого электромагнитного излучения
- •20.3.3. Практическое применение
- •Фотометрические реакции
- •Дифференциальная (разностная) фотометрия
- •Производная спектрофотометрия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ИК-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •Природа вещества
- •Способы получения хроматограммы
- •Хроматографические характеристики, используемые для идентификации веществ (характеристики удерживания)
- •Хроматографические характеристики, используемые для количественного определения веществ
- •Хроматографическая колонка
- •Детекторы
- •Табл. 23.1
- •Характеристика некоторых газохроматографических детекторов
- •ГЛАВА 24
- •24.2.1. Методика получения плоскостной хроматограммы
- •Способы получения плоскостных хроматограмм
- •Некоторые реагенты-проявители, используемые в
- •плоскостной хроматографии
- •Неподвижные и подвижные фазы
- •Ионообменное равновесие
- •ГЛАВА 25
- •Табл. 25.1.
- •Табл. 25.2
- •ГЛАВА 26
- •26.1.5. Потенциометрическое титрование
- •ГЛАВА 27
- •Некоторые современные разновидности вольтамперометрии
- •Предисловие ...................................................................................
- •9.2. Жидкость-жидкостная экстракция ...........................................................
- •9.2.5. Применение экстракции .........................................................................
- •23.1. Общая характеристика .............................................................................
- •Литература .....................................................................................
Инструментальные методы анализа
ГЛАВА 26
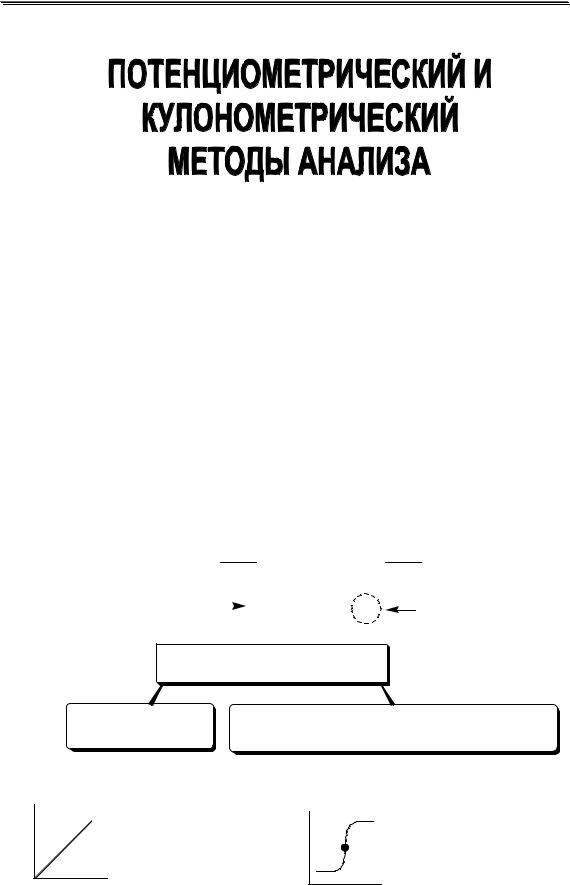
26.1. Потенциометрический метод анализа
Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона.
26.1.1. Общая характеристика и классификация
При потенциометрических измерениях используется электрохимическая ячейка, работающая в режиме гальванического элемента. В состав ячейки входит индикаторный электрод, потенциал которого зависит от активности определяемого иона или от активности хотя бы одного из компонентов протекающей химической реакции, и электрод сравнения (чаще всего хлоридсеребряный), величина потенциала которого постоянна. Величина потенциала индикаторного электрода связана с активностью определяемого иона уравнением Нернста (см. главу 7).
E E0 RT ln |
aox |
E0 0,059 lg |
aox (при 298 К) |
|||
nF |
ared |
|
|
n |
|
ared |
ЭДС гальванического элемента E = E |
ср |
- E |
+ E |
диффузионный |
||
|
|
|
инд |
д |
||
|
|
|
|
|
|
потенциал |
ПОТЕНЦИОМЕТРИЯ |
|
|||||
прямая |
|
|
|
|
косвенная |
|
("ионометрия") |
("потенциометрическое титрование") |
|||||
Измеряют величину ЭДС и по ней |
|
|
Измеряют величину ЭДС, которая |
|||
находят активность (концентрацию) |
изменяется в ходе химической реакции |
|||||
определяемого иона |
между определяемым веществом и титрантом |
|||||
E |
|
E |
|
|
желательно, чтобы |
|
система должна |
|
|
|
|
|
хотя быодна из |
быть обратимой |
|
|
|
|
КТТ |
полуреакцийбыла |
|
|
|
|
|
|
обратимой |
lga |
|
|
|
|
V |
|
|
|
327 |
|
|
|
|
Раздел 3
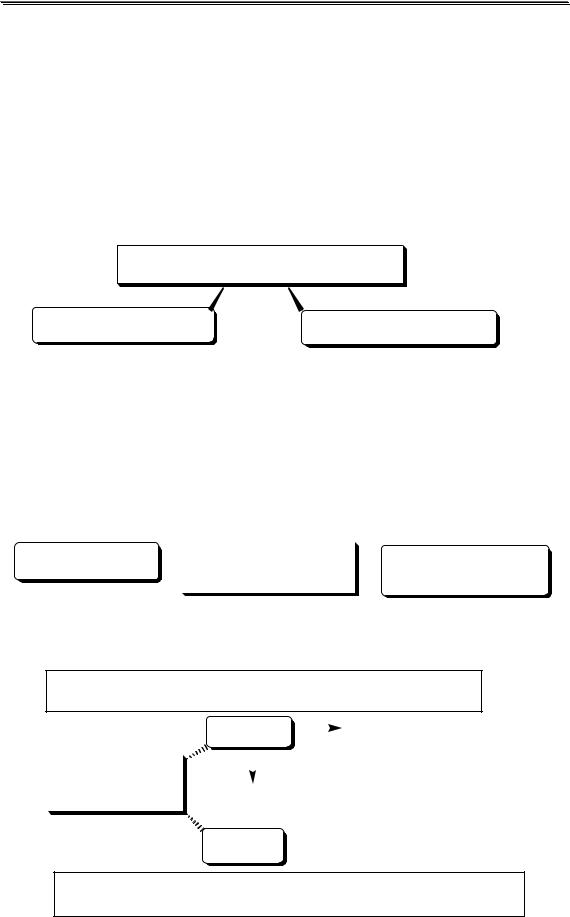
26.1.2. Условия измерения аналитического сигнала
Измерение ЭДС гальванического элемента проводят в условиях, которые близки к термодинамическим:
сила тока, протекающего через ячейку, должна быть равна 0;
время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
При измерении ЭДС в таких условиях можно считать, что величина соотношения aOx / ared у поверхности электрода равна величине
этого соотношения в растворе
МЕТОДЫ ИЗМЕРЕНИЯ ЭДС
компенсационный некомпенсационный
Используют потенциометр |
Используют электронный |
|
Погендорфа |
||
вольтметр с очень большим |
||
см. курс физической химии |
входным сопротивлением (1013 Ом) |
Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионоселективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рНметром.
26.1.3. Индикаторные электроды
|
|
|
|
|
мембранные |
металлические |
|
ИНДИКАТОРНЫЕ |
|
||
имеют электронную |
ЭЛЕКТРОДЫ |
|
(ионоселективные) |
||
|
|
|
|
||
проводимость |
имеют ионную проводимость |
||||
Металлические электроды могут быть
изготовлены из металла, образующего восстановленную форму обратимой окислительно-восстановительной реакции
|
активные |
|
|
|
I рода |
|||
|
|
|||||||
|
|
|
Ag+ |
+ e Ag |
||||
|
|
|
||||||
металлические |
|
|
||||||
|
|
|
|
|
||||
электроды |
II рода AgCl + e Ag + |
Cl- |
||||||
|
|
|
|
Pt |
||||
|
инертные |
Fe3++ e Fe2+ |
||||||
материал электрода не участвует в окислительно-восстановительной реакции и служит лишь переносчиком электронов
328
|
Инструментальные методы анализа |
|
|
||
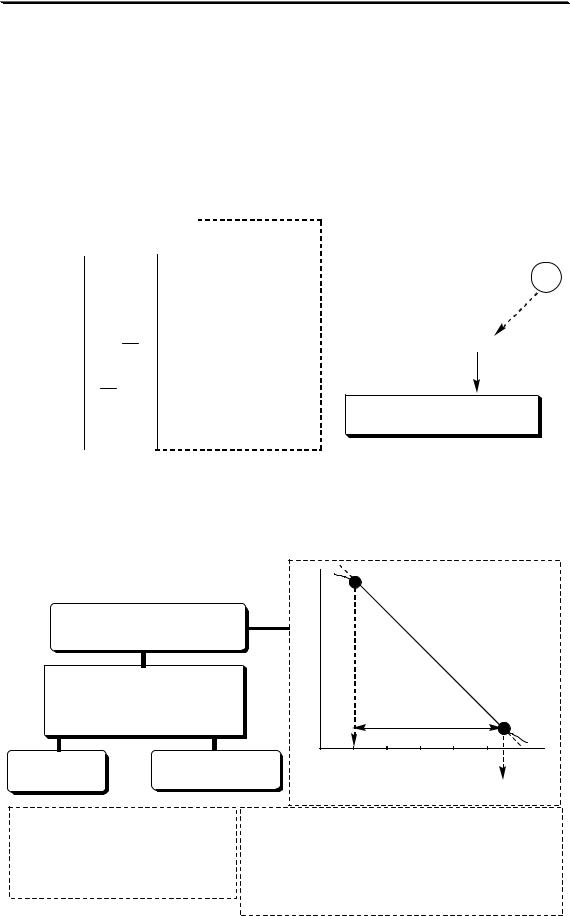
Ионоселективные электроды (согласно IUPAC) – это сенсоры |
|||||
(чувствительные элементы, датчики), потенциалы которых линейно |
|||||
зависят от lg активности определяемого иона в растворе. |
|
||||
В состав большинства ионоселективных электродов входит по- |
|||||
лупроницаемая мембрана, представляющая собой тонкую плёнку, от- |
|||||
деляющую внутренний раствор (стандартный) от внешнего (анализи- |
|||||
руемого) и способную пропускать преимущественно ионы только од- |
|||||
ного вида (рис. 26.1) |
|
|
|
|
|
|
мембранный электрод |
|
|
|
|
полупроницаемая |
|
|
|
|
|
мембрана |
|
|
|
|
|
внешний |
внутренний |
Eм = E1 - E2 = 0,059lg(a1/a2) |
|||
раствор |
раствор |
||||
a (A) = ? |
a2(A) = const |
|
|
|
|
1 |
|
|
|
|
|
|
A A |
|
|
const |
|
|
|
|
|
|
|
A A |
|
Eм = const + 0,059lga1 |
|||
|
|
||||
E1 |
E2 |
|
|
|
|
Рис. 26.1. Принцип работы мембранного электрода |
|
|
|||
К основным характеристикам ионоселективного электрода отно- |
|||||
сят |
|
|
|
|
|
|
|
E, |
|
|
|
интервал выполнения |
мВ |
|
|
|
|
|
|
|
|
||
электродной функции |
|
|
|
|
|
ОСНОВНЫЕ |
|
интервал |
|
|
|
|
выполнения |
|
|
||
ХАРАКТЕРИСТИКИ |
|
электродной |
|
|
|
|
ИСЭ |
|
функции |
|
|
время |
селективность |
1 |
3 |
5 |
pa(A) |
отклика |
|
|
предел определения |
||
|
|
|
|
Время, за которое потенциал |
Определяется потенциометрическим |
||
электрода достигает постоянного |
коэффициентом селективности, отражающим |
||
значения. Чем меньше время |
относительное влияние ионов А и В на величину |
||
отклика, тем лучше электрод. |
мембранного потенциала. Чем меньше его |
||
|
|
величина, тем выше селективность электрода |
|
|
|
относительно иона А |
|
329
Раздел 3
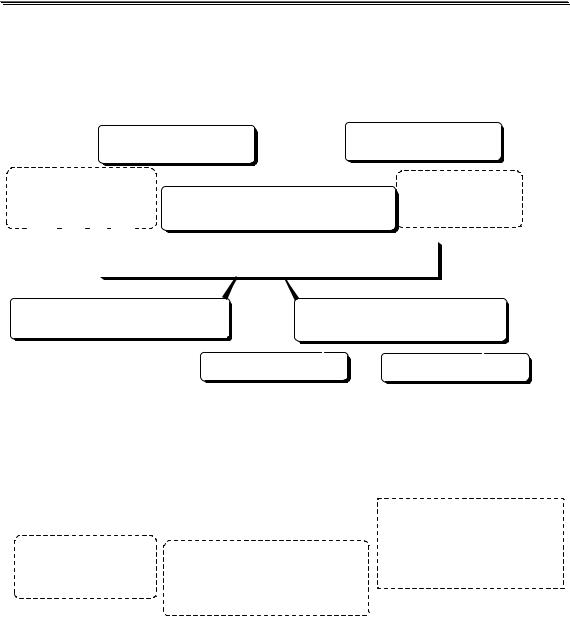
Согласно рекомендациям IUPAC различают следующие виды ионоселективных электродов:
имеют кристаллическую мембрану, |
|
имеют стеклянную мембрану |
|||||||||
изготовленную из индивидуального |
|
||||||||||
|
обладающую селективностью по |
||||||||||
кристаллического соединения или гомогенной |
|
||||||||||
смеси кристаллических веществ |
|
отношению к определённому иону |
|||||||||
|
с жёсткой матрицей |
||||||||||
|
с кристаллическими |
|
|||||||||
|
мембранами |
|
|
|
|
(стеклянные) |
|||||
фторид-селективный |
|
|
|
|
|
|
|
стеклянный рН- |
|||
электрод, имеющий первичные |
ионоселективные чувствительный |
||||||||||
мембрану из LaF3 |
|
электроды |
|
|
электрод |
||||||
|
|
|
|
||||||||
|
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ |
||||||||||
|
|
|
|||||||||
электродыс подвижными |
сенсибилизированные |
||||||||||
носителями |
|
|
|
|
|
электроды |
|||||
имеют жидкую мембрану - |
|
|
|
|
|
|
|
||||
раствор ионообменника |
газочувствительные |
|
|
ферментные |
|||||||
или "нейтрального |
датчики, состоящие из |
|
|
датчики, в которых ИСЭ |
|||||||
переносчика" в |
|
|
|||||||||
индикаторного электрода и |
|
покрыт плёнкой, содержащей |
|||||||||
органическом |
|
||||||||||
электрода сравнения и |
|
|
фермент, способный вызвать |
||||||||
растворителе, |
|
|
|||||||||
имеющие газопроницаемую |
|
|
реакцию превращения |
||||||||
удерживаемый на |
|
|
|||||||||
мембрану или воздушный зазор |
субстрата с образованием |
||||||||||
пористом полимере |
для отделения анализируемого |
веществ, на которые |
|||||||||
или заключённый |
реагирует электрод |
||||||||||
в полимерную |
раствора от тонкой плёнки |
|
|
электрод для определения |
|||||||
промежуточного раствора |
|
|
|||||||||
матрицу |
|
электролита |
|
|
|
|
пенициллина, содержащий |
||||
К-селективный |
электрод для определения |
|
|
фермент пенициллиназу и |
|||||||
|
|
стеклянный рН- |
|||||||||
электрод на основе |
углекислого газа на основе |
|
|
||||||||
|
|
чувствительный электрод |
|||||||||
валиномицина |
стеклянного рН- |
|
|
|
|
|
|||||
|
|
чувствительного электрода |
|
|
|
|
|
||||
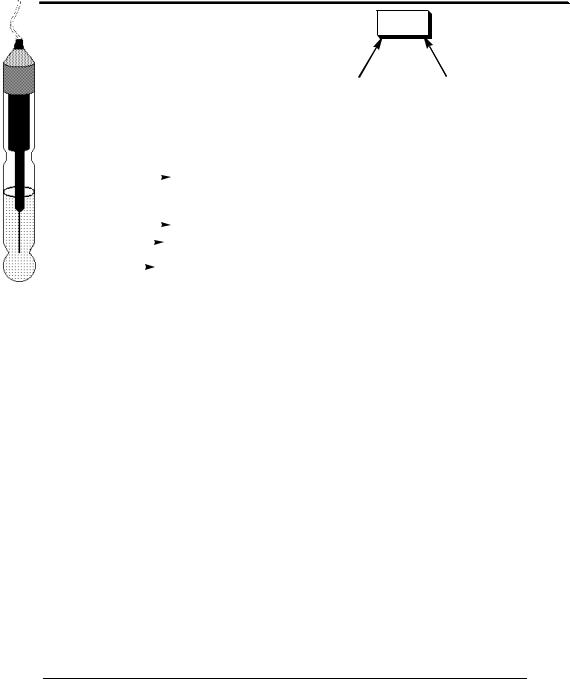
Стеклянный электрод для измерения рН (рис.26.2) имеет тонкую рН-чувствительную мембрану, изготовленную из специального стекла, содержащего 22% Na2O, 6% CaO и 72% SiO2. Внутри электрода находится 0,1 М HCl, насыщенный хлоридом серебра, и хлоридсеребряный электрод сравнения. Перед началом работы электрод, который хранился в сухом виде, вымачивают в 0,1 М HCl. Для того чтобы электрод работал, на внутренней и внешней сторонах мембраны должна образоваться тонкая плёнка гидратированного геля. Ионы водорода должны вытеснить ионы Na+ из пустот на поверхности стекла.
В основе работы стеклянного электрода для измерения рН лежит ионообменное равновесие
H+раствор H+стекло
330
Инструментальные методы анализа
E = const + 0,059lgaH+
|
|
|
|
|
|
|
|
потенциалы |
потенциал асимметрии |
|||||
|
|
|
|
|
|
|
|
внутреннего |
(даже если составы |
|||||
|
|
|
|
|
|
|
|
и внешнего |
внутреннего и внешнего |
|||||
|
|
|
|
|
|
|
|
электродов |
растворов будут |
|||||
|
|
|
|
|
|
|
|
сравнения |
идентичными, потенциал |
|||||
1 |
|
|
|
|
|
электрода не будет равен |
||||||||
|
|
|
|
|
нулю), изменяющийся в |
|||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
процессе эксплуатации |
|||||
2 |
|
|
|
|
|
электрода |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
3 |
|
|
|
|
|
Из-за |
наличия потенциала |
|||||||
|
|
|
|
|
||||||||||
4 |
|
|
|
|
|
|
асимметрии перед началом рабо- |
|||||||
|
|
|
|
|
|
|||||||||
Рис. 26.2. Стеклянный электрод |
ты стеклянный электрод для изме- |
|||||||||||||
рения рН |
градуируют |
по стан- |
||||||||||||
1 – внутренний хлоридсеребряный элек- |
||||||||||||||
трод; 2 – серебряная проволочка; 3 – 0,1 М |
дартным |
буферным |
растворам |
|||||||||||
HCl, насыщенный AgCl; 4 – стеклянная рН- |
(табл. 26.1). |
|
|
|
||||||||||
чувствительная мембрана) |
|
|
|
Табл. 26.1. |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
Стандартные буферные растворы, используемые для |
|||||||||||||
|
|
|
|
градуировки стеклянного электрода |
|
|
|
|||||||
|
|
|
|
|
|
|
Буферная система |
|
|
рН (20 С) |
|
|||
|
|
|
|
0,05 М раствор тетраоксалата калия |
|
|
1,675 |
|
|
|||||
|
насыщенный (20 С) раствор гидротартрата калия |
|
3,557 |
|
|
|||||||||
|
|
|
|
0,05 М раствор гидрофталата калия |
|
|
4,002 |
|
|
|||||
|
|
|
|
0,025 M KH2PO4 / 0,025 М Na2HPO4 |
|
|
6,881 |
|
|
|||||
|
|
|
|
0,01 M раствор тетрабората натрия |
|
|
9,225 |
|
|
|||||
Стеклянный электрод может быть использован для измерения рН в ограниченном диапазоне рН, зависящем от сорта стекла, из которого изготовлена мембрана.
измеренное значение |
|
|
pH = 0 |
|
измеренное значение |
||||
pH больше истинного |
|
pH меньше истинного |
|||||||
|
|
|
|
pH |
|||||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
10-12 |
|
|||||
|
|
|
|
|
конкуренция с ионами |
||||
щелочных металлов
26.1.4. Прямая потенциометрия
В прямой потенциометрии концентрацию (активность) определяемого вещества рассчитывают, исходя из величины ЭДС гальванического элемента. Чаще всего индикаторным в прямой потенциометрии является ионоселективный электрод. Прямые потенциометрические измерения, в которых используется ионоселективный электрод, называются ионометрией. Данный метод анализа характеризуется простотой и экспрессностью методик, недорогой аппаратурой
331
