
- •Тема: окислительно-восстановительные реакции (овр)
- •Интегрированные ключевые умения (выносятся на экзамен)
- •Задания для подготовки к занятиям
- •Обучающие задачи
- •1 Определить степень окисления в молекулах и частицах MnO2; k2MnO4; MnO4–; Mn2o3.
- •2. Определить роли в окислительно-восстановительных реакциях веществ: PbO2, h2o2, hno3, h2so3, h2Se.
- •3. Определить эквиваленты веществ в следующих процессах:
- •1 Моль MnO4–присоединяет 3ē
- •2Моль I-освобождает 2 мольē
- •4. Закончить уравнение реакций
- •Задания для самостоятельной домашней работы
- •Проверьте свои знания и умения
2. Определить роли в окислительно-восстановительных реакциях веществ: PbO2, h2o2, hno3, h2so3, h2Se.
Решение
Степень окисления свинца +4. Это максимальная степень окисления, поэтому PbO2проявляет только окислительные свойства.
Кислород пероксида водорода может уменьшать степень окисления с О-1до О-2(Н2О), а может увеличивать до нуля (О2).
Н2О2+ 2Н++ 2ē= 2Н2О
О2+ 2Н++ 2ē= Н2О2
Поэтому пероксид водорода проявляет окислительные и восстановительные свойства в зависимости от реагента.
Степень окисления азота N+5 в азотной кислоте максимальная. Азотная кислота проявляет только окислительные свойства.
Сера в H2SO3 находится в степени окисления +4, это промежуточная степень окисления, сернистая кислота проявляет и окислительные и восстановительные свойства.
Селен в H2Se находится в степени окисления (–2), поэтому H2Se обладает только восстановительными свойствами.
3. Определить эквиваленты веществ в следующих процессах:
а) MnО4– + 2H2O + 3ē = MnO2 + 4OH–
б) превращение KI I2
Решение
Эквивалентом окислителя (или восстановителя) называется такое его количество, которое присоединяет (или освобождает) 1 моль электронов.
а) Составим пропорцию:
1 Моль MnO4–присоединяет 3ē
х моль MnO4–присоединяет 1ē;
отсюда: 1/х = 3/1; х = 1/3, эквивалент MnO4–в данном процессе равен 1/3.
б) 2I-- 2ē=I20;
2Моль I-освобождает 2 мольē
х моль I-освобождает 1 мольē,
отсюда 2/х = 2/1; х = (2 1)/2 = 1, эквивалентKIв данном процессе равен 1.
4. Закончить уравнение реакций
а) HBr+KMnO4MnBr2+
б) KI+KNO2+CH3COOHNO+
в) P2O3+H2OPH3+
г) As3O33-+I2+H2OAsO43- +
Решение
а) т. к. бром находится в минимальной степени окисления -1, то он может повысить степень окисления до 0 (Br2), марганец находится в максимальной степени окисления, может понизить свою степень окисления, т.к. среда кислая, то доMn2+, который связывает ионыBr–, образуется также вода
HBr + KMnO4 MnBr2 + Br2 + H2O + KBr
б) азот был в степени окисления +3, понизил степень окисления до +2(NO), поэтомуI-должен только повысить степень окисления, обычно доI2
KI + KNO2 + CH3COOH I2 + NO + CH3COOH + H2O
в) фосфор изменяет степень окисления с +3 до –3. Другие элементы в данной реакции не измменяют степень окисления. Поэтому фосфор должен повысить степень окисления до +5, продукты:
P2O3+H2O PH3 + H3PO4
г) мышьяк меняет степень окисления с +3(AsO33-) до +5(AsO43-). Иод тогда должен понизить степень окисления до –1(I-). Продукты:
As3-+I2+H2OAsO43-+ 2I– ,
или в молекулярном виде:
K3AsO4 + I2 + H2O K3AsO4 + HI.
Умение 6. Подобрать коэффициенты в уравнениях (умения 5 ).
а) HBr + KMnO4 MnBr2 + Br2 + H2O + KBr
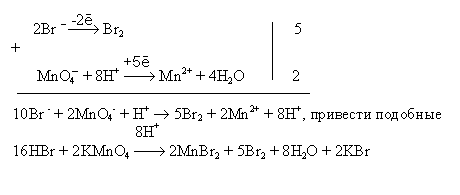
Умения 6– см. обучающие задачи в [5].
Задания для самостоятельной домашней работы
Теория. [1], [2], [3]- стр. 164-173;
Задачи. [3]- стр. 173. № 5(4, 7, 9);7(4,5) ,[5] 643, 651, 683, 685, 688,691
Химический эксперимент
Опыт 1.Описание в [3] стр. 298 оп.(6.б)
Для реакций взаимодействия перманганата калия с сульфитом калия в кислой, нейтральной и щелочной среде снять по таблице показания электродных потенциалов данных систем и определить в какой среде система марганца будет иметь самые сильные окислительные свойства.
Опыт 2. Описание [3] Стр. 282. Опыт 1.а. Использовать кроме сульфата меди дополнительно раствор иодистого калия. Составить схемы электролиза этих растворов.
