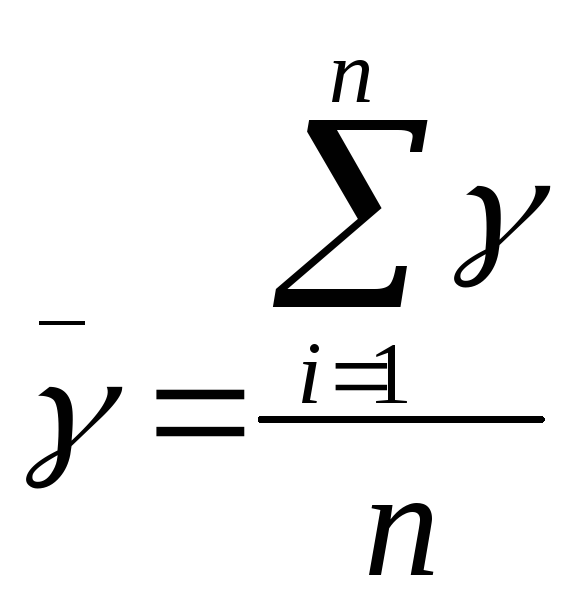Физика 6м
.docГОУ ВПО
ДВГУПС
Кафедра “Физика”
Лабораторная работа На тему: “Изучение некоторых термодинамических состояний газов”.
21040165 06М 911
Шифр Номер работы Группа
Выполнил
Черных Д. С.
Проверил: Старший преподаватель кафедры “Оптические системы связи”
Бодров Е. А.
Хабаровск 2006 г.
Цель работы:
Определить отношение удельных теплоемкостей воздуха при постоянном давлении и постоянном объеме.
Приборы и оборудование:
-
Стеклянный баллон с краном
-
Жидкостный манометр
-
Микрокомпрессор
Краткая теория:
Термодинамикой называется раздел физики, в котором изучаются условия превращения одного вида энергии в другой и качественные соотношения при таких превращениях. В основе термодинамики лежат экспериментально доказанные законы термодинамики.
Основными параметрами
состояния системы являются: давление
![]() ,
удельный объем
,
удельный объем
![]() и температура
и температура
![]() .
.
Между данными параметрами существует связь, называемая уравнением состояния
Для облегчения рассмотрения термодинамических процессов вводится понятие идеальный газ (газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающее малые собственные объемы).
Одной из важнейших физических характеристик газов является теплоемкость. Теплоемкость газов делится на удельную (величина, численно равная количеству теплоты, которое необходимо сообщить единице массы газа, чтобы увеличить его температуру на один градус) и молярную (величина, численно равная количеству теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус). Обе данные теплоемкости зависят от условий в которых протекает нагревание газа.
Используя уравнение состояния идеального газа и первый закон термодинамики можно сформулировать эту зависимость.
Если при изменении температуры объем газа не меняется, то этот процесс называется изохорным – все подводимое к газу тепло идет на увеличение внутренней энергии, работа равна нулю.
Нагревание, протекающее при постоянном давлении с изменением объема является изобарным процессом – подводимое тепло увеличивает внутреннюю энергию, а также идет на совершение газом работы.
Также существует процесс именуемый изотермическим, при котором при уменьшении давления увеличивается объем, а температура остается неизменной – в данном процессе не происходит изменения внутренней энергии, но совершается максимальная работа.
Одна из особенностей
молярной теплоемкости в том, что она
целиком определяется природой газа.
Отношение теплоемкости газа
![]() к
к
![]() называется показателем адиабаты (
называется показателем адиабаты (![]() ).
Данная величина играет очень большую
роль в проведении термодинамических и
газодинамических расчетов, в особенности
связанных с адиабатическими процессами.
).
Данная величина играет очень большую
роль в проведении термодинамических и
газодинамических расчетов, в особенности
связанных с адиабатическими процессами.
Процесс при котором газу предоставлена возможность быстро расширяться, причем изменение объема газа осуществлять без теплообмена с окружающей средой называется адиабатическим.
При адиабатическом процессе изменяются все три основных параметра. Например, при адиабатическом сжатии изменяется не только объем и давление газа, как при изотермическом процессе, но также изменяется и температура. Это происходит вследствие того, что за счет работы, затрачиваемой на сжатие газа, увеличивается его внутренняя энергия. Следовательно, уменьшение объема газа при адиабатическом сжатии должно повлечь за собой большее, чем при изотермическом сжатии, увеличение давления.
Расчетные формулы:
![]() - значение показателя
адиабаты (для каждого измерения в
отдельности)
- значение показателя
адиабаты (для каждого измерения в
отдельности)
 - среднее значение
показателя адиабаты
- среднее значение
показателя адиабаты
![]() - абсолютная
погрешность среднего значения адиабаты
(для каждого измерения в отдельности)
- абсолютная
погрешность среднего значения адиабаты
(для каждого измерения в отдельности)
 - абсолютная
погрешность среднего значения адиабаты
(общая)
- абсолютная
погрешность среднего значения адиабаты
(общая)
![]() - показатель
адиабаты с учетом среднего значения
показателя адиабаты и его абсолютной
погрешности.
- показатель
адиабаты с учетом среднего значения
показателя адиабаты и его абсолютной
погрешности.
Проведем измерения и на их основании рассчитаем необходимые данные:
-
Рассчитаем значения показателей адиабаты для каждого измерения в отдельности:

![]()
![]()
![]()

-
Далее найдем среднее значение показателя адиабаты:

-
Затем вычислим абсолютную погрешность среднего значения адиабаты для каждого измерения в отдельности:
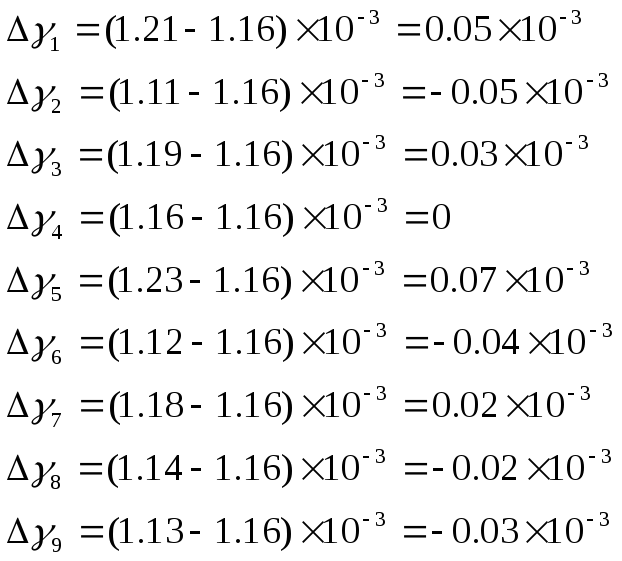
-
После чего рассчитаем общую абсолютную погрешность среднего значения адиабаты:

-
И в завершение работы узнаем показатель адиабаты с учетом среднего значения показателя адиабаты и его абсолютной погрешности:

Систематизируем результаты лабораторной работы в виде таблицы:
|
№ измерения |
|
|
|
|
|
|
|
1 |
235 |
40 |
1,21 |
1,16 |
0,05 |
0,014 |
|
2 |
120 |
12 |
1,11 |
0,05 |
||
|
3 |
170 |
27 |
1,19 |
0,03 |
||
|
4 |
150 |
21 |
1,16 |
0 |
||
|
5 |
185 |
35 |
1,23 |
0,07 |
||
|
6 |
174 |
18 |
1,12 |
0,04 |
||
|
7 |
195 |
30 |
1,18 |
0,02 |
||
|
8 |
120 |
15 |
1,14 |
0,02 |
||
|
9 |
260 |
30 |
1,13 |
0,03 |
Вывод:
Выполняя данную работу, я на практике пронаблюдал особенности некоторых термодинамических процессов, в частности адиабатический процесс. При помощи специального оборудования я определил отношение удельных теплоемкостей воздуха при постоянном давлении и постоянном объеме, а также, используя вышеуказанные формулы, я вычислил среднее значение адиабаты и его абсолютную погрешность.
Кроме того, я убедился в истинности начал термодинамики и некоторых термодинамических зависимостях.