
Постулаты Бора_1
.docТеория Бора водородоподобных атомов.
Нильс Бор создал теорию строения атома, способную объяснить опыты Резерфорда и спектр излучения паров водорода.
Спектр характеризует распределение интенсивности излучения по шкале частот (или по шкале длин волн).

Постулаты Бора.
1-й постулат:
электрон в атоме может двигаться только по определенным стационарным орбитам, находясь на которых, он не излучает и не поглощает энергию. Момент импульса электрона на этих орбитах кратен постоянной Планка:
![]() , (1)
, (1)
me
– масса электрона,
![]() - скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
- скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
![]() Дж·с
– постоянная Планка.
Дж·с
– постоянная Планка.
2-й постулат:
при переходе электрона с одной стационарной орбиты на другую излучается или поглощается фотон, энергия которого
![]() .
(2)
.
(2)
E
n1
и
E
n2
- энергия электрона в состоянии 1 и 2
(т.е. на орбитах 1 и 2),
![]() - частота электромагнитных волн,
- частота электромагнитных волн,
![]() -
постоянная Планка.
-
постоянная Планка.
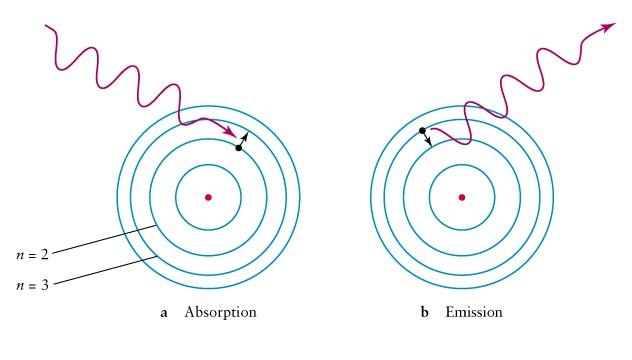
Радиус орбиты электрона в атоме водорода.
1-й
постулат Бора,
![]() .
.
Выразим скорость электрона:
![]() .
(3)
.
(3)
Рассмотрим круговые электронные орбиты. На электрон с зарядом -e со стороны ядра с зарядом +e действует сила Кулона F, сообщая электрону нормальное ускорение,
![]()
![]() .
.
По 2-му закону Ньютона,
 .
(4)
.
(4)
Сократим
![]() и подставим скорость из (3):
и подставим скорость из (3):
![]() .
.
Отсюда
 .
.
Радиус
первой орбиты электрона (n
= 1), называется радиусом
Бора
![]() ,
,
![]() =
=

![]() 0.53·10-10
м.
0.53·10-10
м.
Радиус орбиты электрона в атоме водорода
![]() ,
n
=1,2,3,…. – номер орбиты.
,
n
=1,2,3,…. – номер орбиты.
Энергия электрона в атоме водорода.
Энергия
электрона представляет собой сумму
кинетической энергии
![]() и
потенциальной
и
потенциальной
![]() .
.
![]() и
и
![]() .
.
Потенциальная
энергия – это энергия электрона с
зарядом
![]() в электрическом поле ядра. Из уравнения
(4) видно, что
в электрическом поле ядра. Из уравнения
(4) видно, что
![]() .
.
Тогда на n –ой орбите энергия электрона равна
![]() =
=
![]() =
=![]() .
.
Т.е. кинетическая энергия электрона равна полной энергии, взятой со знаком «-».
Также полную энергию можно записать через потенциальную:
![]() =
=![]() , или
, или
![]() .
.
Подставим
![]() .
Тогда
.
Тогда
![]() =
=
![]() .
.
Энергия на первой орбите (на первом энергетическом уровне) равна
![]() =
=
![]() = -13,6 эВ.
= -13,6 эВ.
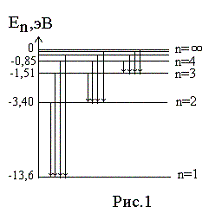
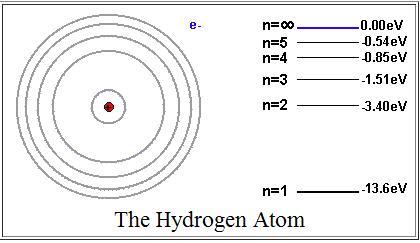
Величину
![]() =
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
=
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
![]() =
=
![]() .
.
Спектр излучения водорода.
Энергия излучаемого или поглощаемого кванта:
![]() .
.
Частота
![]() ,
,
![]() длина волны,
длина волны,
![]() - скорость света в вакууме.
- скорость света в вакууме.
![]() =
=
![]() +
+
![]() =
=
![]() ,
,
![]() =
=
![]() .
.
![]() =
=
![]() -
формула Бальмера,
-
формула Бальмера,
определяет длины волн в спектре атома водорода.
![]() =
1,1∙107
м-1
- постоянная Ридберга.
=
1,1∙107
м-1
- постоянная Ридберга.
![]() и
и
![]() - номера энергетических состояний
(номера орбит) электрона.
- номера энергетических состояний
(номера орбит) электрона.
Переходы
электрона с возбужденных энергетических
состояний на основной энергетический
уровень (![]() = 1) сопровождаются излучением в УФ
области
спектра (серия линий Лаймана),
= 1) сопровождаются излучением в УФ
области
спектра (серия линий Лаймана),
переходы
на уровень с
![]() = 2 приводят к линиям в
видимой области
(серия Бальмера),
= 2 приводят к линиям в
видимой области
(серия Бальмера),
переходы
на уровень с
![]() = 3, 4, 5, … приводят излучению в ИК
области.
= 3, 4, 5, … приводят излучению в ИК
области.


Теория Бора не смогла объяснить строение сложных атомов. Для объяснения поведения микрочастиц была развита квантовая механика.
Она основана на том, что любая микрочастица, наряду с корпускулярными, обладает также волновыми свойствами (гипотеза де Бройля).
Для фотона, импульс
![]() .
.
По аналогии с фотоном, любую микрочастицу можно рассматривать как волну с длиной волны
![]() ,
,
![]() -
длина волны де Бройля.
-
длина волны де Бройля.
Гипотеза де Бройля подтверждена экспериментально наблюдением дифракции электронов, а затем и протонов.
Принцип неопределенностей.
