
Астраханский государственный технический университет

Методическое руководство
по выполнению лабораторной работы по
дисциплине "Химия"
Определение
эквивалентной массы цинка

Астрахань 2006
Определение эквивалентной массы цинка: Методическое руководство по выполнению лабораторной работы по дисциплине "Химия" / Глинина Е.Г. – Астрахан. гос. техн. ун-т, 2006. – 8 с.
Цель работы:
Знакомство с экспериментальными методами установления эквивалентов металлов на примере определения эквивалентной массы цинка по объёму выделившегося водорода в реакции:
Zn + 2НСl → ZnСl2 + Н2↑
-
Введение
Для металлов, взаимодействующих с кислотами и щелочами с выделением водорода, одним из наиболее удобных и точных методов определения их эквивалентных масс является метод вытеснения водорода.
Суть метода сводится к следующему: взвешивают определенную массу металла, эквивалентную массу которого нужно определить, и растворяют его в избытке кислоты (или щелочи). Определяют объём выделившегося водорода. Определив объём, можно рассчитать и массу водорода. Зная массу металла, объём (или массу) водорода с помощью закона эквивалентов вычисляют эквивалентную массу металла.
-
Материальное обеспечение
Реактивы:
цинк (гранулы или стружка),
разбавленная (1:2) соляная кислота.
Приборы и оборудование:
|
Мерный цилиндр на 250 мл |
Измерительная линейка |
|
Круглодонная колба с газоотводной трубкой |
Технохимические весы с разновесами ( или электронные ) |
|
Ванночка |
Термометр |
|
Полоски фильтровальной бумаги |
Лабораторные штативы с «лапками» |
|
Барометр |
-
Указания по технике безопасности
В данной работе определенную опасность представляет лишь соляная кислота, поэтому при работе с ней следует соблюдать все меры предосторожности, принятые при работе с кислотами.
-
Задание к лабораторной работе и методические рекомендации по его выполнению
Для проведения опыта необходимо собрать установку (рис. 1):
а) ванночку (1) чуть больше, чем наполовину по высоте заполнить водопроводной водой. Затем в цилиндр (2) до самого края наливается вода. Ладонью закрывают отверстие цилиндра, переворачивают цилиндр отверстием вниз и, не отнимая ладони, опускают его в ванночку с водой. Под водой ладонь осторожно выводится из под цилиндра и он закрепляется в вертикальном положении в «лапке» одного из штативов. Если в цилиндр попал воздух, описанную процедуру следует повторить;
б) на технохимических весах взвешивают цинк с точностью до 0,01 г. Для того, чтобы выделившийся при реакции водород поместился в цилиндр, куда он будет поступать (объем цилиндра 250 мл), необходимо взять массу цинка в пределах от 0,50 до 0,57 г, то есть от 500 до 570 мг;
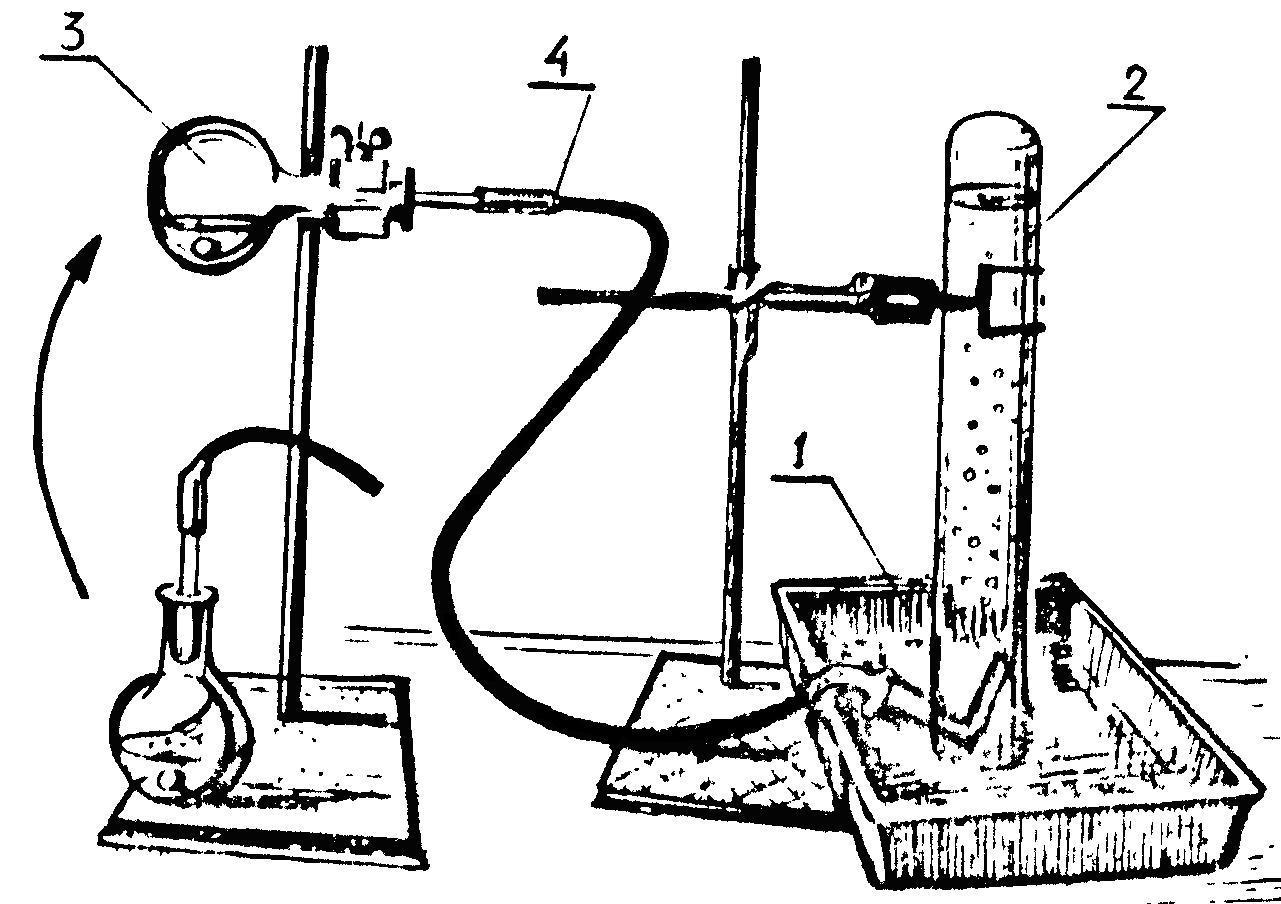
Рис. 1. Установка для проведения эксперимента
в) в колбу (3) наливают разбавленную (1:2) соляную кислоту. Кислоты нужно налить столько, чтобы она при придании колбе горизонтального положения, не переливалась в горлышко колбы. В этом случае гарантируется избыток соляной кислоты для взвешенного количества цинка. Если налить кислоты очень мало, то её на данное количество цинка может не хватить и часть цинка не прореагирует. После этого протереть насухо фильтровальной бумагой внутреннюю поверхность горла колбы и закрепить колбу в «лапке» штатива, придав колбе горизонтальное положение;
г) на внутреннюю поверхность горла колбы помещают взвешенный цинк (осторожно!) так, чтобы он не упал в кислоту, и плотно закрывают колбу газоотводной трубкой (4). Изогнутый конец газоотводной трубки подводят под отверстие цилиндра с водой;
д) после этого переносят цинк в кислоту, переворачивая колбу в вертикальное положение.
После окончания
опыта (когда весь цинк растворится) по
делениям мерного цилиндра определяют
объем выделившегося в реакции водорода
![]() .
Линейкой измеряют расстояние между
уровнем оставшейся воды в цилиндре и
уровнем воды в ванночке h мм (остаточный
столб воды). Желательно все данные опыта
(mZn,
.
Линейкой измеряют расстояние между
уровнем оставшейся воды в цилиндре и
уровнем воды в ванночке h мм (остаточный
столб воды). Желательно все данные опыта
(mZn,
![]() ,
Т, Ратм,
Рпара,
,
Т, Ратм,
Рпара,
![]() )
записать в таблицу.
)
записать в таблицу.
|
Данные для расчетов |
|||||
|
mZn, г |
мл |
h, мм |
Ратм, мм. рт. ст. |
Т, К |
Рпара, мм. рт. ст. |
|
|
|
|
|
|
|
