
- •Химическая связь - это различные виды взаимодействия, обуславливающие устойчивое существование двух- и многоатомных
- •Ковалентная связь.
- •Объединяются атомы только с противоположными спинами.
- •Проникновение электронных облаков взаимодействующих атомов друг в друга – это
- •Льюис предположил: устойчивые внешние электронные конфигурации у молекул могут возникнуть в результате обобществления
- •Правило октета: стремление к созданию устойчивой электронной конфигурации благородного газа (2-х или 8-и
- •Энергия и длина связи
- •С уменьшением длины связи энергия связи растёт и соответственно, устойчивость молекул увеличивается.
- •Метод валентных связей (ВС)
- •При сближении атомов с антипараллельными спинами происходит уменьшение энергии системы, т.к. увеличивается электронная
- •В образовании химической связи участвуют электроны внешней оболочки.
- •При образовании связи изменения претерпевает электронная структура внешних оболочек и подоболочек атомов.
- •Характеристики ковалентной связи
- •Электрический момент диполя м - равен векторной сумме электрических моментов диполей связей, имеющихся
- •Дипольный момент, приходящийся на связь, рассматривают как вектор. При этом надо учитывать вклад
- •Дипольный момент многоатомной молекулы можно считать равным векторной сумме дипольных моментов всех связей
- •Необходимо учитывать природу многоатомных заместителей в молекуле.
- •Эффективные заряды.
- •Значения эффективных зарядов в подгруппе уменьшаются, например:
- •Поляризуемость, ( ) - способность молекулы становиться полярной (или более полярной) под действием
- •Насыщаемость.
- •Определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
- •Механизм образования ковалентной связи
- •Образование молекулы Н2О
- •2) Донорно-акцепторный механизм:
- •Направленность.
- •Может возникать при перекрывании орбиталей s - s, р - р, d-d-типа, а
- •Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра – боковое перекрывание
- •Число связей между атомами называется
- •Гибридизация атомных орбиталей
- •Гибридизация – это изменение формы атомной орбитали за счет комбинации с другими атомными
- •Условия устойчивости гибридизации:
- •Виды гибридизации
- •sр2- составлены из одной s и двух р - орбиталей, всего их 3.
- •sp3 - составлены из одной s и трёх р - орбиталей, всего их
- •Пространственная структура молекул
- •Состояние sp3-гибридизации - угловая структура
- •Четырехатомные молекулы имеют два типа структур
- •Тяжелые элементы, из-за рыхлой структуры электронных оболочек связи чаще образуются чистыми p- и
- •В молекулах СН4, NН3, Н2О углерод, азот и кислород имеют sp3 тип гибридизации,
- •Гибридизация с участием d – орбиталей
- •Недостатки метода валентных связей
- •Атом кислорода имеет два неспаренных электрона.
- •Метод молекулярных орбиталей (МО)
- •Молекулярная орбиталь (МО) – волновая функция, которая описывает состояние электрона в поле двух
- •Метод ЛКАО
- •Перекрывание атомных орбиталей а и в соответствует сложению электронных плотностей, и возникает молекулярная
- •Если спины электронов атомных орбиталей параллельны, то эти электроны отталкиваются, и электронные плотности
- •При сложении, электронная плотность в области между ядрами возрастает и образуется связь, энергия
- •электронная плотность между ядрами равна нулю, атомы расталкиваются и энергия системы двух атомов
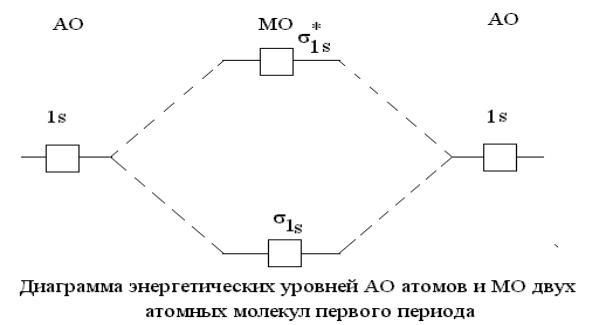
- •Образование связывающей и разрыхляющей молекулярной орбитали из атомных s-орбиталей.
- •МО, получающиеся при комбинации s атомных орбиталей называются σs МО.
- •При комбинации 2рх атомный орбиталей образуются две σх МО (где х – линия,
- •При комбинации двух ру и двух рz атомных орбиталей образуются две πу и
- •У связывающих МО электронная плотность сосредоточена между ядрами, это снижает запас энергии и
- •Порядок заполнения МО
- •Второй электрон поступит на ту же орбиталь и образуется нейтральная молекула водорода Н2.
- •Молекула Не2 должна была бы содержать 4 электрона – два связывающих и два
- •Схема образования молекулярных орбиталей у двухатомных молекул второго периода
- •По мере заполнения связывающих МО прочность связи повышается: увеличивается её порядок, уменьшается длина
- •Если два электрона находятся на одной орбитали, то их магнитные поля замыкаются.
- •Для разноименных атомов учитывается I.
- •Построение МО для молекул с гибридизацией
- •Достоинства метода МО:
- •Общие черты ММО и МВС
- •Ионная связь
- •Атомы, отдавшие часть электронов, приобретают положительный заряд и становятся положительно заряженными ионами –
- •Схема образования NaC1
- •Связь, которая образуется за счёт электростатического взаимодействия разнополярных ионов называется ионной.
- •Ионная связь, характеризуется:
- •Поляризация иона - это относительное смещение ядра и окружающих его электронов внешней электронной
- •Различают поляризуемость и поляризующую силу.
- •Поляризующая сила иона - это его способность деформировать, поляризовать другой ион.
- •Изменение радиуса
- •Поляризация ионов влияет на свойства соединений:
- •Металлическая связь
- •Металлическая связь – это связь, в которой электрон каждого отдельного атома принадлежит всем
- •Межмолекулярные взаимодейсвия Ван-дер-ваальсовы силы.
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •Молекула
- •Ван-дер-ваальсовы силы действуют между молекулами лишь при близком расположении.
- •Донорно-акцепторное взаимодействие
- •Водородная связь
- •Если водородная связь образуется между разными молекулами, то она называется межмолекулярной.
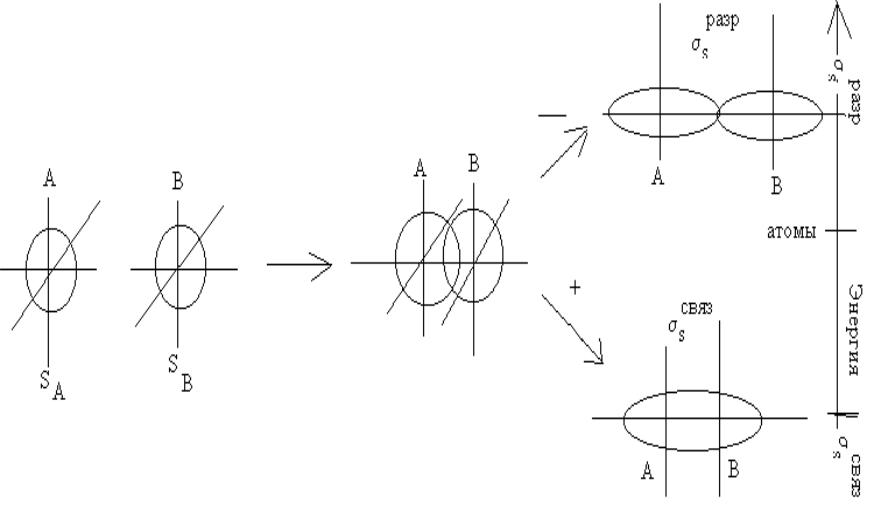
Образование связывающей и разрыхляющей молекулярной орбитали из атомных s-орбиталей.
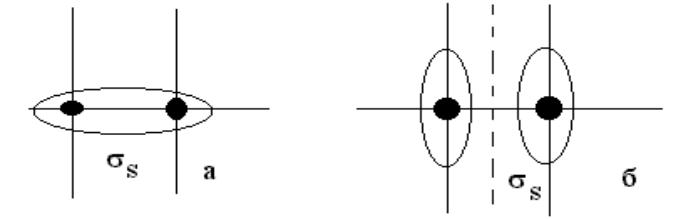
МО, получающиеся при комбинации s атомных орбиталей называются σs МО.
Две атомные s – орбитали дают две молекулярные орбитали: свs и разрs, на которых
может быть размещено всего четыре электрона. Энергетический уровень связывающей орбитали ниже, чем разрыхляющей.
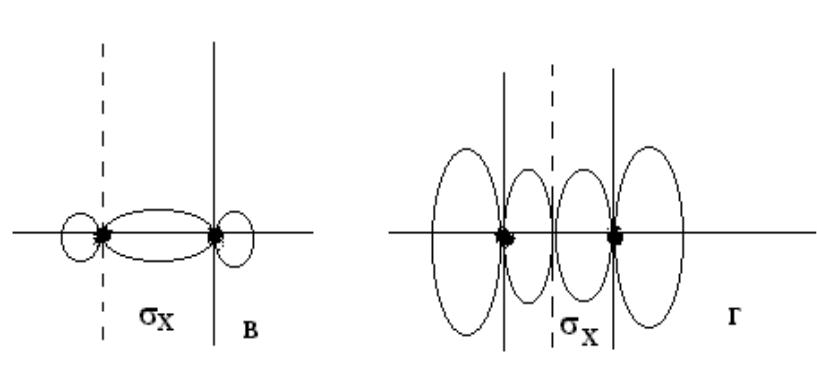
При комбинации 2рх атомный орбиталей образуются две σх МО (где х – линия, соединяющая ядра атомов) - св2р(х) и разр2р(х).
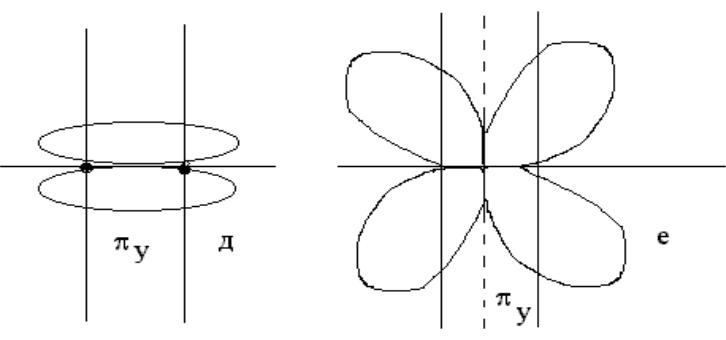
При комбинации двух ру и двух рz атомных орбиталей образуются две πу и две πz МО - св2р(у) иразр2р(у) из ру- орбиталей, св2р(z) и разр2р(z) из рz орбиталей, т.к. ру и рz орбитали перекрываются боковыми поверхностями, поэтому образуются - связи.
У связывающих МО электронная плотность сосредоточена между ядрами, это снижает запас энергии и упрочняет молекулу.
Разрыхляющие МО имеют пониженную электронную плотность между ядрами, поэтому они не связывают атомы в молекулу.
π МО образуются при комбинации p- и d – АО, и некоторых d-АО. Кроме того при комбинации d-АО образуются δ-МО.
Электрон, пределах одного подуровня, в первую очередь занимает в вакантную связывающую-МО.
Порядок заполнения МО
σsсв(1s); σsраз(1s); σsсв(2s); σsраз(2s); πyсв(2py); πzсв(2pz); σxсв(2px); πyраз(2py); πzраз(2pz) ;σxраз(2px) и т.д.
Порядок связи = (Nесв - Nераз) / 2
Nесв, Nеразр–число связывающих и разрыхляющих электронов.
Если Nесв=Nеразр, то порядок связи равен нулю, и молекула
не образуется. Если порядок связи равен 1 – связь одинарная или простая. Если порядок связи не равен единице, то связь - кратная.
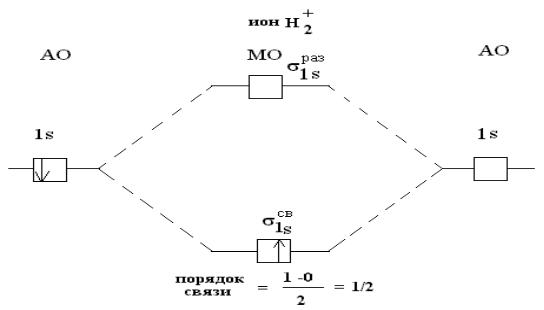
Второй электрон поступит на ту же орбиталь и образуется нейтральная молекула водорода Н2. Два электрона на 1sсвяз-орбитали упрочняют систему: энергия связи в молекуле Н2 выше, чем в Н2+.
Третий электрон вступает на разрыхляющую 1sраз – орбиталь, поэтому молекула Н2- очень непрочная.
Система, состоящая из двух протонов и четырех электронов Н22- не обнаружена.
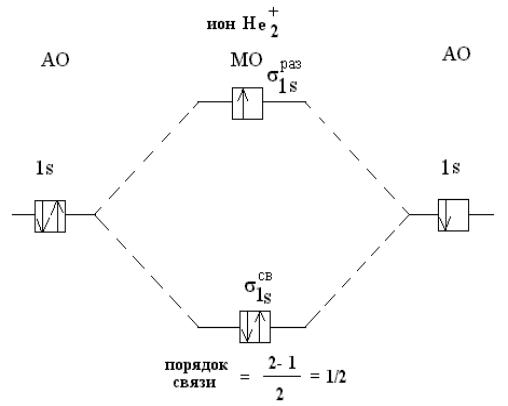
Молекула Не2 должна была бы содержать 4 электрона – два связывающих и два разрыхляющих, и в невозбужденном состоянии она неизвестна.
Но молекула с двумя связывающим и одним разрыхляющим электроном (Не2+) устойчива и существует.
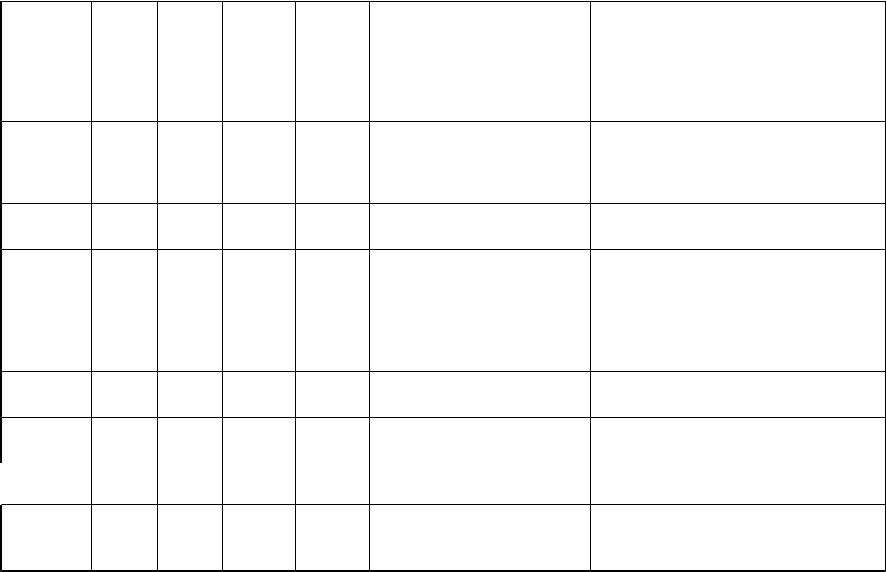
Схема образования молекулярных орбиталей у двухатомных молекул второго периода
Тип
МО
σхраз
π ураз πzраз
σхсв
π усв πzсв
σхраз
σхсв
Nсвязи
 l, нм
l, нм
Е, кДж/ моль
Li |
Be |
B |
C |
N |
2 |
O |
2 |
F |
Ne |
2 |
CN- |
NO |
NO+ |
2 |
2 |
2 |
2 |
|
|
2 |
|
|
|
|
|||
- |
- |
- |
- |
|
- |
|
- |
- |
↑↓ |
- |
- |
- |
|
- |
- |
- |
- |
|
- |
↑ |
↑↓↑↓ |
↑↓ |
|
- |
↑ |
- |
|
- |
- |
- |
- |
|
- |
|
↑ |
|
↑↓ |
- |
- |
- |
|
- |
- |
- |
- |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||
- |
- |
↑ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||
- |
- |
↑ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||
- |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||
1 |
0 |
1 |
2 |
|
3 |
|
2 |
1 |
0 |
|
3 |
2,5 |
3 |
0,27 |
- |
0,16 |
0,13 |
0,11 |
0,12 |
0,14 |
- |
|
0,14 |
0,12 |
0,11 |
||
107 |
- |
288 |
627 |
940 |
494 |
159 |
- |
|
940 |
678 |
1048 |
||
