
- •Кафедра общей и медицинской химии
- •Шведский инженер-химик, изобретатель, промышленник.
- •Закон Менделеева-Клайперона
- •Закон Дальтона (для газовых смесей)
- •Нефтяные газы, воздух используются при синтезе ряда веществ. Природный, доменный, генераторный газы являются
- •Анестезирующее давление некоторых газов для мышей
- •Воздух представляет собой смесь 78% азота, 21% кислорода
- •Растворимость газов в жидкостях
- •2) от характера жидкости
- •3) от температуры - повышение температуры уменьшает растворимость газов
- •Закон Генри (растворенное вещество более летуче, чем растворитель).
- •а) Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
- •Следствия из закона Генри
- •Реальные газы отклоняются от закона Генри, и тем сильнее, чем выше парциальное давление
- •Закон Дальтона (для смеси газов)
- •Закон Сеченова (1859)
- •Одной из причин уменьшения растворимости газов является гидратация ионов электролитов, в результате чего
- •Значение законов Дальтона, Генри и Сеченова
- •2. Расчет парциальных давлений О2 и СО2 при дыхании:
- •3.Предотвращение кессонной болезни
- •Кесонная болезнь сопровождается:
- •Кесонная болезнь может возникнуть также в результате резкого уменьшения давления при разгерметизации скафандров
- •Барокамера используется не только для декомпрессии, но и для насыщения организма кислородом при
- •4. Расчет содержания газов в жидкостях (из закона Генри)
- •6. Озонотерапия (О3)
- •Доказано, что озон в терапевтических концентрациях оказывает следующие действия:
- •"Коллигативные свойства растворов."
- •Граф структуры
- •Коллигативные (коллективные) - зависят от количества имеющихся молекул или ионов растворенного вещества, а
- •1. Понижение давления пара растворителя: (нелетучее вещество в летучем растворителе)
- •Причины:
- •Для идеальных растворов понижение давления насыщенного пара растворителя не зависит от природы растворенного
- •2. Эбулиоскопия – повышение Ткип
- •Ткип Кэ ·m,
- •3. Криоскопия – понижение Т замерзания
- •Тзам ККр.·m
- •Растворы различных веществ в воде замерзают при температуре ниже 0oС
- •Антифризы - вещества, понижающие температуру замерзания водных растворов
- •4. Осмос. Осмотическое давление.
- •Причина осмоса - стремление вещества распределяться равномерно по всему объему растворителя.
- •Закон Вант-Гоффа
- •Одномолярный раствор создает давление 22,4 атм!!! 46
- •За счет осмотического давления мог бы удерживаться столб морской воды высотой около 238
- •Ученые предполагают, что египтяне откалывали гранитные глыбы, заливая помещенные в расщелины скал стволы
- •Осмотическое давление плазмы крови человека - 7.4-7.8 атм
- •Для растворов электролитов в формулу вводится коэффициент Вант-Гоффа i
- •Осмометры
- •Онкотическое давление
- •Физиологические растворы
- •Изоосмия
- •Изо-, гипер- и гипотонические растворы
- •Осмотический стресс (конфликт) : пребывание в воде, которая либо неестественно богата минеральными веществами,
- •Осмотический шок: внезапное изменение концентрации растворенных солей - например, если рыбу без постепенной
- •Изменения, происходящие с кровяными тельцами в растворах NaCl различной концентрации
- •Рабочие «горячих» цехов должны пить подсоленную воду, так как в результате повышенного потоотделения
- •Лизис, плазмолиз, гемолиз.
- •Изменения, происходящие с кровяными тельцами в растворах NaCl различной концентрации
- •Немецкие ученые Эрвин Неер и Берт Сакманн
- •Целлюлит
- •Для нормализации соле- и водообмена в клетку нужно
- •Типичные для целлюлита выпячивания жировой ткани
- •По мнению диетологов, ирония кроется в том, что многие женщины, изнуряющие себя строгими
- •Консервирование продуктов питания происходит благодаря
- •Тургор
- •Гипергидратация
- •Гипогидратация – обезвоживание организма вследствие значительного снижения поступления воды в организм, либо чрезмерные
- •Значение осмотического давления
- •2. Осмотическая очистка морской воды
- •3. Перитонеальный диализ.
- •4. При очистке ран от гноя и носителей инфекции используют гипертонические марлевые повязки,
- •6. Осмос и диализ - основа ряда физиологических процессов: усвоение пищи, окислительные процессы
- •Спасибо за внимание!
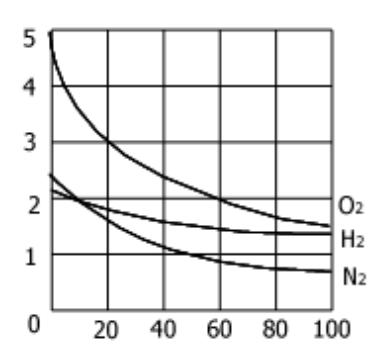
3) от температуры - повышение температуры уменьшает растворимость газов
График зависимости растворимости газов от температуры. Растворимость падает при нагревании, что особенно заметно в случае с кислородом.
4) от давления - повышение давления увеличивает
растворимость газов |
11 |
|
Закон Генри (растворенное вещество более летуче, чем растворитель).
12
а) Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
Cж K·P
Сж - концентрация газа в жидкости,
Р– его давление над раствором,
К– коэффициент, зависящий от природы газа, растворителя и температуры.
б) Парциальное давление газа над раствором прямо пропорционально его мольной доле.
pi po ·Nраств. в-ва
po – давление пара чистого растворенного вещества
13
Следствия из закона Генри
1. Отношение концентрации газа, растворенного в жидкости, к концентрации его над раствором при постоянной температуре есть величина постоянная
2. Объем растворенного газа не зависит от внешнего давления (при увеличении давления в одинаковое число раз возрастает как концентрация растворенного газа, так и концентрация газа над раствором )
14
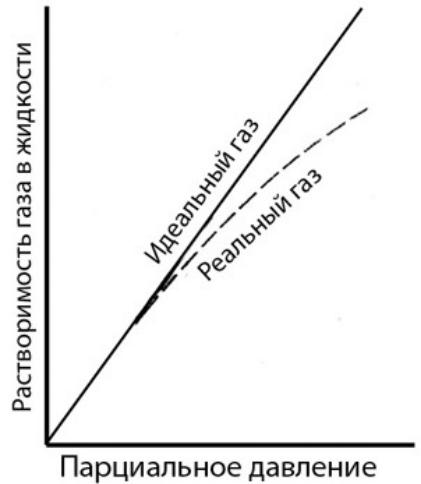
Реальные газы отклоняются от закона Генри, и тем сильнее, чем выше парциальное давление газа.
15

Закон Дальтона (для смеси газов)
Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью:
 Ci K·Pi
Ci K·Pi 
(в математическое выражение закона Генри вместо общего подставляют парциальное давление Pi, данного компонента)
16
Закон Сеченова (1859)
(в растворителе присутствует электролит)
Растворимость газов в жидкостях в присутствии электролитов понижается
S S0e kc ,
So растворимость газа в воде
S - растворимостью газа в растворе электролита С - концентрация растворенного вещества
е — основание натурального логарифма
k — константа, значение которой зависит от |
|
природы газа, электролита и температуры |
|
ln S0 |
kc. |
S |
17 |
Одной из причин уменьшения растворимости газов является гидратация ионов электролитов, в результате чего уменьшается
число свободных молекул растворителя и понижается его растворяющая способность.
В крови концентрация электролитов, белков, липидов
может меняться в известных пределах и оказывает влияние на растворимость О2 и СО2 в
крови.
Добавление кристаллов |
|
соли или сахара в шампанское |
|
приводит к интенсивному |
|
выделению СО2 |
18 |
Значение законов Дальтона, Генри и Сеченова
1. Расчет прочности тары для газосодержащих напитков
Проявлением закона Генри– Дальтона и моделью эмболии является образование обильной пены при откупоривании бутылки шампанского.
19

2. Расчет парциальных давлений О2 и СО2 при дыхании:
|
Альвеолы |
Венозная |
|
кровь |
|
|
|
|
pO2 143.9 → → 8087 |
||
pCO2 |
52.7 ← ← 61 |
|
|
|
|
20
