
1 лекция. Окси- и гидрокси- кислоты
.pdf
Лекция
Гетерофункциональные соединения:
гидрокси – и оксокислоты. Оптическая изомерия.
1
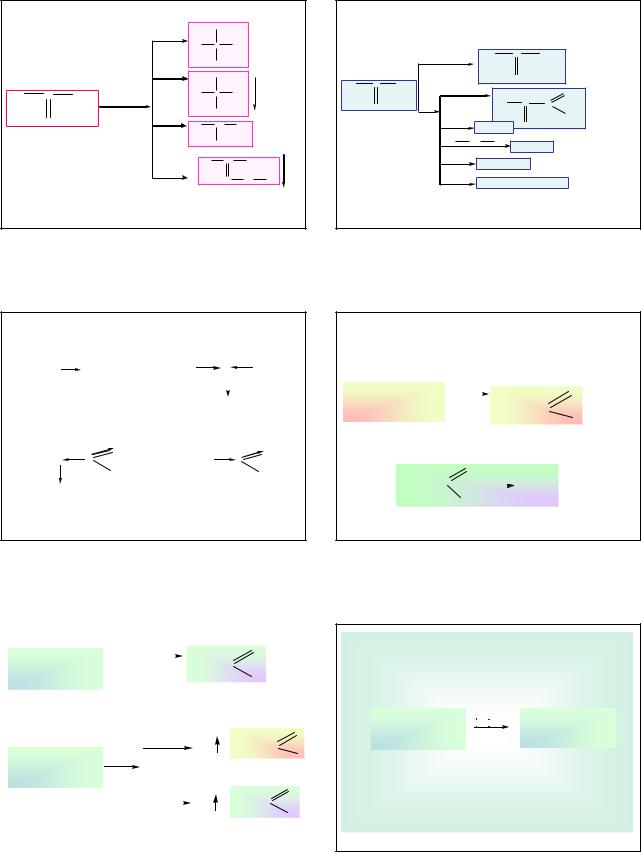
Этим свойством обладают вещества, которые представляют собой хиральные объекты. (Кельвин, конец XIX в.)
Cheir (греч.) рука.
Хиральными - называют объекты, для которых отсутствуют ось и плоскость симметрии. Они оказываются несовместимыми со своим зеркальным изображением.
В органических молекулах хиральным объектом является am.С, окруженный 4-мя различными заместителями (С в sp3 гибридизации). Этот атом называется асиметрическим (Вант-Гофф, конец XIXв.)
3
Если молекула имеет один такой атом, то она хиральна, а растворы такого вещества, проявляют оптическую активность.
Хиральные молекулы всегда имеют своих зеркальных «двойников»- оптических антиподов, по строению являющихся их зеркальным отображением.
5
Оптическая изомерия.
- )
 .
. глаз
глаз
Неполяризованный луч
Изменение плоскости
поляризации
Призма Николя
Оптическая активность - это свойство отклонять плоскость поляризованного света, а вещества которые проявляли оптическую активность назвали оптически активными.
2
зеркало
4
Изомеры, относящиеся друг к другу как предмет и зеркальное отображение и имеющие одинаковые химические и физические свойства называются энантиомерами (оптические изомеры).
Энантиомер, отклоняющий луч света по часовой стрелке, называют правовращающим и обозначают
(+), а его антипод – левовращающим (-).
6
1

Классы органических соединений, среди которых много оптически активных соединений - - гидроксикислоты,- аминокислоты (кроме глицина ).
* |
|
COOH |
Общая формула - |
|||
R |
|
CH |
|
|||
|
|
|||||
|
|
|
|
|
|
гидроксикислот. |
|
|
OH |
|
|||
|
|
|
|
|
|
|
7
1). CH3 |
|
|
Одна из важнейших |
|||
|
CH |
|
COOH |
- гидроксикислот - |
||
|
|
|||||
|
|
|
|
|
|
- 2 – гидроксипропановая кислота |
|
|
|
|
(молочная) соли – лактаты. |
||
|
|
OH |
||||
Для изображения оптического изомера на плоскости используют формулу Фишера.
|
COOH |
HO |
H |
|
CH3 |
|
L (+) = + 3,82о |
|
COOH |
|
При брожении |
|
сахаров при |
|
помощи особых |
H |
OH бактерий |
|
CH3 |
|
D (-) = - 3,82о |
8
(+) – правовращающая молочная кислота – называется мясомолочной.
9
Количество энантиомеров определяется по формуле N=2n, где n – количество хиральных атомов.
Для молочной кислоты n = 1, следовательно N = 2, это (+) и (-) формы. Но кроме оптических изомеров всегда существует смесь, состоящая из равных количеств (+) и (-) антиподов. Она называется рацемической и не является оптически активной.
Такой , например, является молочная кислота, полученная под действием молочнокислых бактерий при скисании молока, квашении капусты, солении огурцов, помидоров.
Существуют следующие способыразделения рацемической смеси:
1. Механический – отбор кристаллов по внешнему виду (кристаллы имеют зеркально-скошенные грани);
2. Микробиологический – (+) и (-) оказываютразноефизиологическое действие намикроорганизмы, которые избирательно поглощаютодин антипод.
3.Химический – основан на химической реакции антипода с оптически деятельным веществом – это основной способ разделения.
4.Хроматографический – расщепление рацематов на оптически активных сорбентах.
|
Химический метод. |
|
|
|
|
смесь солей |
|
|
|
диастереомеры |
|
рацемат |
оптич. актив. |
разделение |
|
кристаллизацией |
|||
(кислота) |
(основание) |
||
соль |
|||
|
|
||
|
соль |
разложение солей |
|
|
|
11 |
2). HOOC |
CH |
CH2 |
COOH |
|
- яблочная кислота |
|
|||
|
|
|
|
|
2- гидроксибутандиовая |
|
|||
|
|
OH |
|
|
( - гидроксиянтарная) |
|
|||
|
|
|
|
|
соли: малаты |
|
|
||
Дикарбоновая (2СООН) и трехатомная (3ОН) кислота. |
|
||||||||
|
В организмеона получается следующим образом: |
|
|||||||
HOOC |
CH2 |
CH2 |
COOH |
E |
|
HOOC |
CH |
CH |
COOH |
-2H |
|
||||||||
|
янтарная |
|
|
|
фумаровая |
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
+H2O, E |
HOOC |
CH |
CH2 |
COOH |
O |
HOOC |
C |
CH2 |
COOH |
|
|
OH |
|
дальнейшее |
O |
|
|
||
|
|
яблочная |
щавелевоуксусная |
||||||
|
|
окисление |
|||||||
|
|
|
|
превращаетябл. |
|
|
|
||
|
|
|
|
к-ту в щавелево- |
|
|
12 |
||
|
|
|
|
уксусную. |
|
|
|||
|
|
|
|
|
|
|
|||
2

Формулы Фишера для яблочной кислоты.
|
|
COOH |
|
|
COOH |
||||
|
H |
|
|
H |
|
H |
|
|
OH |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
CH2COOH |
|
|
CH2COOH |
||||
L (-) природная яблочная кислота |
D (+) яблочная кислота |
||||||||
13
3). |
HOOC |
|
CH |
|
CH |
|
COOH |
– дигидроксиянтарная кислота |
||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
– винная кислота |
|
|
|
OH |
|
OH |
|
|
|
||
Должна иметь 22 = 4 – энантиомера.
Реально существуют 2 оптически активных изомера + 1 оптически неактивная форма.
Уменьшение количества энантиомеров связано с появлением в молекуле плоскости симметрии, так как 2 С* имеютодинаковую конфигурацию.
а). |
|
COOH |
|
|
|
|
|
|
|
COOH |
|
||||||
H |
|
|
|
OH |
|
|
|
|
|
OH |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
HO |
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
энантиомеры |
|
|
|
|
|
|
|
|||
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
COOH |
|
|||||||
tпл. = 170о(+) [ ]20 + 12о |
|
|
|
(-) = -12о, tпл. = 170о |
|||||||||||||
Природная винная кислота |
|
|
|
|
|
|
14 |
||||||||||
Плоскость симметрии
Мезовинная кислота – оптически неактивная форма из-за внутренней компенсации.
Мезовинная получается при кипячении со щелочами всех изомеров.
Мезоформа – конфигурация молекулы с 2-мя одинаковыми С*, имеющей плоскость симметрии.
15
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
N |
3 |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|||
R |
|
CH |
|
COOH |
|
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
||
- aminoacid
R CH2 COOH
|
|
-HCl |
|
Cl2, , h |
Схема введения 2ой |
|
|
||||||||||||||||||
|
|
or |
|
|
|
|
|
|
функциональной группы в |
||||||||||||||||
|
|
|
|
|
|
|
|
карбоновуюкислоту. |
|
|
|||||||||||||||
|
|
-HBr |
Br2 , P red |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
CH |
|
|
|
COOH |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|||
|
- halogenacid |
|
|
|
|
C |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
- |
O |
|
|
N |
|
|
|
|
|
||||
|
|
|
|
|
|
|
+ H2O |
|
|
H |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
H |
|
|
2 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
(OH - ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
R |
|
|
CH |
|
|
|
|
|
COOH |
|
|
R |
|
CH |
|
|
|
COOH |
|
|
||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
C |
|
NH2 |
|
||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
- hydroxyacid |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- ureidoacid |
17 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
- oxoacid |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
г). Рацемическая смесь получается при длительном кипячении с Н2О любого изомера. Она называется виноградной кислотой. Это смесь (+) и (-) кислот.
|
|
|
|
|
|
|
|
H2O2 |
|
|
|
|
|
|
|
|
|
|
HOOC |
|
CH |
|
CH |
|
COOH |
|
|
|
HOOC |
|
CH |
|
CH |
|
COOH |
||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
OH |
|
|
||
Винная кислота оптически не активна, отличается по физическим свойствам (tпл.=200С). При её синтезе всегда получается рацемическая смесь.
16
Гидроксикислоты.
Гомологический ряд гидроксикислот:
1.O Гидроксиметановая кислота
|
HO |
|
|
C |
Гидроксимуравьиная |
||||
|
|
||||||||
|
|
|
|
|
|
|
OH |
Угольная (H2CO3) |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
O |
|
Гидроксиэтановая кислота |
|
CH2 |
|
|
C |
|
|||||
|
|
||||||||
|
|
|
|
|
|
|
OH |
|
Гидроксиуксусная |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Гликолевая |
|
|
|
OH |
|
|
|
|
|||
Кристаллическое вещество, tпл.=80, легко растворяется в воде. Содержится в недозрелых плодах.
18
3
3а). |
|
|
|
|
|
б) |
|
|
|
|
|
|
||
CH3 |
|
CH |
|
COOH |
|
CH3 |
|
CH2 |
|
COOH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|||
|
2-гидроксипропановая |
|
|
|
3 - гидроксипропановая |
|||||||||
|
-гидроксипропионовая |
|
|
- гидроксипропионовая |
||||||||||
|
молочная кислота |
|
|
- молочная кислота |
||||||||||
|
|
|
|
|
|
|
|
|||||||
эфирысоли } |
лактаты |
|
|
|
|
|
|
|
|
|
||||
4). Из изомеров гидроксимасляной кислоты особый интерес представляет изомер
|
|
|
|
|
|
|
- гидроксимасляная кислота |
CH2 |
|
CH2 |
|
CH2 |
|
COOH |
|
|
|
|
|||||
|
|
|
|
|
|
|
4 – гидроксибутановая кислота |
OH |
|
|
|
|
|
|
|
|
Накапливается в организме больных сахарным |
||||||
диабетом как промежуточный продукт - окисления жирных кислот. Является предшественником
ацетоуксусной кислоты (АУК). |
19 |
2). Свойсва – СООН |
|
|
|
|
O |
|
|
||
кислотные свойства |
CH3 |
CH |
C |
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
- NaOH |
|
|
OH |
ONa |
|
|
|
|
O |
|
|
|
|
|
|
|
CH3 |
|
декарбоксилирование |
|
|
|
|
|||
CH |
C |
|
|
|
|
||||
- CO2 |
|
CH3 |
CH2 |
|
|
|
|||
|
|
OH |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
реакция SN |
обр. сложных эфиров |
|
O |
|||
|
|
|
|
+ROH, H+ |
|
CH3 |
CH |
C |
|
|
|
|
|
|
|
|
|
OH |
OR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PCl5 галогенангидрид |
|
O |
|||
|
|
|
|
-POCl3, -HCl |
|
|
|
||
|
|
|
|
|
CH3 |
CH |
C |
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
Cl |
|
|
|
|
|
амид |
|
|
|
|
|
|
|
|
NH3 |
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
O |
|
|
|
|
|
CH3 |
CH |
C |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
OH |
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21 |
|
Химические свойства гидроксикислот |
|||||||
|
Химическое |
поведение |
всех |
гетерофункциональных |
||||
соединений складывается из свойств каждой функциональной |
||||||||
группы и свойств, обусловленных ихвзаимным влиянием. |
||||||||
|
1). Свойство ОН гр. |
|
CH3 |
C |
|
COOH |
||
|
|
|
|
|
пировиноградная |
|||
|
|
|
|
[ O ] |
|
|
|
|
|
|
|
|
-H20 |
|
O |
|
|
CH3 |
CH |
COOH |
+HCl , H+ |
CH3 |
CH |
COOH |
||
|
|
|
2 - хлорпропановаяк-та |
|||||
|
|
|
|
-H2O |
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
CH3 |
CH |
COOH |
|
|
|
|
CH3OH |
|
|
|
2 – метоксипропановая |
|
МОЛОЧНАЯКИСЛОТА |
|
|
H2SO4, t |
|
|
|
(простойэфир) |
|
|
|
-H2O |
|
OCH3 |
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
CH3COOH, H+ |
CH3 |
CH |
COOH |
|
|
|
|
|
-H2O |
|
|
|
сложныый эфир |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
C |
CH3 |
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
O |
|
3). Специфические свойства:
а). При t0 в присутствии разбавленной Н2SO4 образуется НСООН и альдегид
|
O H |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t, H2SO4 |
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
|
C C |
OH |
|
|
|
HCOOH |
|
|
CH3 |
|
C |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б). При t.  образуются лактиды. межмолекулярные сложные эфиры.
образуются лактиды. межмолекулярные сложные эфиры.
К специфическим свойствам гидроксикислот относится их склонность к дегидратации. А особенность заключается в том, что , , , ( , ) – изомеры ведут себя по разному.
22
Винная кислота – дигидроксиянтарная кислота.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
CH |
|
CH |
|
|
COOH |
|
- соли тартраты |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Получение |
|
|
|
|
|
|
|
KMnO4 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
CH |
|
|
|
CH |
|
|
|
|
COOH |
|
|
|
O |
|
|
|
|
H2O |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нейтр. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
HOOC |
|
|
CH |
|
|
|
|
CH |
|
|
COOH |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
23
|
|
|
|
Химические свойства: |
|||||
1). По СООН группе – образование солей. |
|||||||||
|
|
а). + КОН |
гидротартрат К – нерастворимый осадок |
||||||
|
|
(качественная реакция на К +). |
|||||||
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
||||||
|
C |
|
|
|
|
|
C |
|
|
|
|
OH |
|
KOH |
|
|
|
OK |
|
|
|
CHOH |
|
|
|
|
CHOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
CHOH |
|
|
|
|
|
CHOH |
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
C |
|
|
|
|
OH |
|
|
|
|
|
OH |
|
|
|
б). осадок + NaOH |
– Н2О cегнетова соль. |
|
|||||
24
4
|
в). Осадок + Cu(OH)2 |
|
реактив Фелинга |
|
|
|
|||||
|
O |
|
|
O |
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
OK |
|
|
OK |
|
|
Раствор |
ярко |
синего |
||
|
CHOH |
|
CH |
O |
|
|
|||||
|
|
|
цвета, |
медный |
алкоголят |
||||||
|
|
CuSO4 + NaOH |
|
Cu |
|||||||
|
|
|
виннокислого калия - натрия |
|
|||||||
|
CHOH |
- H2O |
CH |
O |
|
|
|
|
|
|
|
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
C |
|
C |
|
|
РеактивФелинга |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||
|
ONa |
|
|
ONa |
|
|
|
|
|
|
|
|
Служит для обнаружения |
|
|
группы в альдегидах и |
|
C |
|
||||
|
углеводородах. |
|
|
|
|
|
|
|
|
OK |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH |
OH |
|
|
O |
|
|
|
|
|
|
|
|
|
R |
C |
+ Fheling |
- H2O |
Cu O+ R |
C |
|
+ |
CH |
OH |
||
|
reagent |
|
2 |
|
OH |
|
|
O |
|||
|
|
H |
|
red |
|
|
|
||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ONa |
|
|
Химические свойства: |
|
|
|||
1) при t0 сН2SО4 разлагается |
|
|
|
|
|||
CH2COOH |
|
|
|
CH2COOH |
|
||
|
|
|
|
|
|
||
|
O H |
H2SO4 |
, t |
|
|
|
|
C |
COOH |
|
HCOOH |
+ |
C |
O |
|
CH2COOH |
|
t |
|
CH2COOH |
|
||
|
|
|
CO2 + H2O |
|
t |
|
|
|
|
|
|
CO2 |
+CH3 |
C |
CH3 |
CO + 2CO2 + H2O +CH3 |
C |
CH3 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
27 |
2). - ОН карбоновыекислоты при температуреобразуют |
|||||
непредельные кислоты |
|
|
|
||
CH3 |
CH |
CH2 |
COOH |
t |
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
OH |
|
|
|
|
|
- гидроксимасляная кислота |
|
|
||
|
t |
CH3 |
CH |
CH |
COOH |
|
-H2O |
||||
|
|
|
Кротоновая кислота |
||
|
|
|
|
||
|
|
|
|
|
29 |
Лимонная кислота.
|
|
|
|
OH |
-2-гидроксипропан-1,2,3, |
|||||
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
CH2 |
|
C |
|
CH2 |
|
COOH |
-трикарбоновая кислота. |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
COOH
Содержится в больших количествах в плодах цитрусовых – лимоне, апельсине, вишне.
В промышленноммасштабе получаютиз листьев махорки |
|
|
|
|
||
|
|
|
|
|
|
|
|
Биосинтез ЛK в цикле Кребса – по |
|
|
|
|
|
|
|
O |
|
|||
|
типу альдольной конденсации ЩУК и |
|
H3C |
|
C |
|
|
ацетилкофермента А- |
|
|
|
SKoA |
26 |
Специфические реакции , , , - гидроксикарбоновых кислот при нагревании.
1). - ОН карбоновые кислоты |
|
|
при температуре образуют |
||||||||||||||||
межмолекулярные циклические сложные эфиры - лактиды. |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
C |
|
OH |
|
HO |
|
|
CH |
|
|
CH3 |
|
t |
|||||
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-2H2O |
||
CH3 |
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
||
|
|
CH |
|
|
OH |
|
|
|
C |
|
O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
– УСТОЙЧИВЫЙ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ШЕСТИЧЛЕННЫЙЦИКЛ |
||
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH |
|
O |
|
- лактид молочной кислоты |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
O |
C |
CH |
|
CH3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3). - и - ОН – карбоновые кислоты – образуют внитримолекулярные сложные эфиры – лактоны.
CH2 |
|
|
CH2 |
|
|
OH |
|
t |
|
CH2 |
|
|
CH2 |
||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
CH2 |
|
|
C |
|
|
OH |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
CH2 |
|
C |
|||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
ГОМК – в анестезиологии применяется как неингаляционный наркоз.
30
5
|
Фенолокислоты. |
|
|
б). по СООН группе (производные, имеющие практическое |
|
||||||
|
|
|
значение). |
|
|
|
COONa |
|
|||
|
|
|
|
|
|
|
|
|
|||
1). Салициловая кислота – 2 – гидрокибензойная, содержит 2 |
|
+ Na2CO3 |
|
|
|
OH |
|||||
функциональные группы: |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
- NaHCO3 |
|
|
|
|
||
а). Химические реакции по ОН- - гр. |
|
|
|
|
COOH |
|
|
|
|
||
|
|
|
|
Интенсивное |
|
|
O |
|
|
||
|
COOH |
|
|
|
|
|
Салицилат натрия |
||||
COOH |
|
|
фиолетовое |
|
|
|
OCH3 |
||||
FeCl3 |
|
|
OH |
|
C |
||||||
|
- HCl |
|
Cl |
окрашивание |
CH3OH, H |
+ |
|
|
|
||
|
|
|
|
|
|
|
|||||
|
O |
|
Fe |
(качественная |
|
-H2O |
|
OH |
|
|
|
|
OH |
|
Cl |
|
|
|
|
||||
|
|
|
|
реакция на |
|
|
|
|
|
|
|
|
|
|
|
фенол) |
|
|
|
|
|
O |
|
|
COOH |
|
|
|
|
|
|
|
|
C |
OC6H5 |
|
|
|
|
|
|
|
Метилсалицилат |
|
|||
|
|
|
|
|
|
|
C6H5OH, H+ |
|
|
OH |
|
|
|
O |
C |
CH3 |
|
|
- H2O |
|
|
|
|
|
(CH3CO)2O |
|
|
|
|
|
|
||||
|
- CH3COOH |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ацетилсалициловая кислота |
|
|
|
Фенилсалицилат (салол) |
||||||
|
|
|
(аспирин) |
31 |
|
|
|
|
|
32 |
|
|
|
|
|
|
|
|
|
|
|
||
в). Специфические реакции, обусловленные влиянием 2х групп друг на друга:
|
t |
OH |
|
|
|
|
декарбоксилирование |
|
COOH |
- CO2 |
|
|
|
|
|
|
фенол |
OH |
|
|
|
|
COOH |
Салициловая кислота |
Усиление кислотных свойств (pK = 2.98) |
|
|
|
Бензойная |
|
|
кислота |
|
|
33 |
Оксокислоты.
Оксокислоты – карбоновые кислоты, содержащие >С=О группу:
|
|
|
C |
|
|
|
(альдегидо –( |
) и кетокислоты |
|
). |
|||
|
|
|
||||
|
|
|
|
|
|
|
O
А – кислоты.
Простейший представитель - глиоксалевая (глиоксиловая) кислота.
O |
|
|
|
C |
|
COOH |
|
|
|||
H |
|
|
|
|
35 |
||
г). Пара-аминосалициловая кислота (ПАСК).
COOH
OH- противотуберкулезное
средство антагонист
n – аминобензойной кислоты, необходимой
для нормальной жизнедеятельности микроорганизмов.
NH2
34
|
|
|
H |
|
А – кислоты неустойчивы, так как |
C |
группа легко |
||
|
||||
окисляется и восстанавливается. |
O |
|
||
|
|
|
|
|
|
H |
|
|
|
|
C |
COOH |
|
|
|
O |
|
|
|
|
O |
|
H |
|
HOOC |
COOH |
|
CH2 |
COOH |
|
|
|
||
Щавелевая кислота |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
36 |
|
|
|
Гликолевая кислота |
|
6

Кетонокислоты являются более устойчивыми, чем альдегидокислоты. Значительнуюроль в биохимических процессах играют следующие кетонокислоты:
|
|
CH3 |
|
|
|
|
|
C |
|
|
|
|
|
|
COOH |
|
- Пировиноградная к-та |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ПВК) |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
- 2 – оксопропановая |
||
CH3 |
|
|
|
|
|
C |
|
|
|
|
|
|
CH2 |
|
|
|
|
COOH |
|
- Ацетоуксусная к-та |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(АУК) |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 3 – оксобутановая |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
C |
|
|
|
C |
|
|
CH2 |
|
|
|
C |
OH |
- Щавелевоуксусная к-та |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ЩУК) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
- 2 – оксобутандиовая |
||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
C |
|
|
C |
|
|
CH2 |
|
|
|
CH2 |
|
|
|
C |
|
- - оксоглутаровая к-та |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
- 2 – оксопентандиовая |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
37 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические свойства:
!!! Химические свойства оксокислот определяются наличием 2-х функциональных групп.
1). >С=О |
AN. |
2). |
кислотные свойства |
|
SN |
3). Специфическиереакции – обусловленывзаимным влиянием
2х групп.
Более сильныекислотные свойства, чем у соответствующих ОН- К.К.
– реакции декарбоксилирования
38
I)Пировиноградная кислота (ПВК)
|
CH3 |
|
|
|
C |
|
|
|
COOH |
центральный продукт углеводного |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обмена. |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Это жидкость, tкип. = 165 0. |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
Cпособы получения: |
|
|
|
|
|
|
|||||||
1). Окислениемолочной кислоты (2 – гидроксипропановой). |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
KMnO4, H2SO4 |
|
|
|
|
|
|
|
||||
C H |
|
|
|
CH |
|
|
|
|
COOH |
+ |
O |
|
|
CH |
3 |
|
C |
|
COOH |
||||
3 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
O H |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
39 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3). Гидролиз (щелочной) дигалогенокислот
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
COOH |
|
+ 2H2O |
|
( OH- ) |
|
|
|||||
CH3 |
|
C |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
-2HCl |
|
|
||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
OH- |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
-2HCl |
|
CH3 |
|
|
C |
|
|
COOH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|||
41
|
2). |
|
гидролиз - оксонитрилов |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
||||
|
CH3 |
|
C |
|
+ KCN |
|
|
|
|
CH3 |
|
|
C |
|
|||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
|
|
|
|
|
|
|
|
|
-NH4 |
|
2H2O, H+ |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические свойства.
1)Реакция >С=О - АN.
2)Реакции – СООН – кислые свойства, реакции SN.
3)Специфические реакции, обусловленные влиянием 2х этих групп друг на друга –
декарбоксилирование ( с расщеплением С – С связей).
42
7
|
1). Реакция >С=О - AN. |
|
|
|
|
|
2). Реакции – СООН группы. |
|
|
|
|
||||
|
|
|
|
CN |
|
|
|
|
|
|
|
||||
|
|
|
|
|
2- циано-2- |
|
|
|
|
|
|
|
|
|
|
|
|
|
HCN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гидроксип |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH- - следыCH3 |
C |
COOH |
ропановая |
|
|
|
CH3 |
|
C |
COONa |
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|
||||
|
|
|
|
OH |
|
|
|
|
кисл. св-ва, обр-е солей |
|
|
|
|
Пируват Na |
|
|
|
|
|
|
|
|
|
+NaOH |
|
|
|
|
|
||
|
|
|
NaHSO3 |
CN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
белый |
CH3 |
C |
- H2O |
|
|
|
O |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|||
CH3 |
C |
COOH |
CH3 |
C |
COOH |
осадок – кач. |
|
|
|
|
+ |
|
|
|
O |
|
|
|
AN |
|
|
реакция на |
|
|
+ C2H5OH, H |
CH3 |
C |
C |
Этилпируват |
||
|
|
|
|
|
|
>C=O |
|
O |
|
(сложный эфир) |
|||||
|
|
|
|
SO3Na |
|
|
SN |
|
|
|
|
|
|||
|
|
|
H2, Pd |
|
|
|
|
|
|
|
|
|
|
OC2H5 |
|
|
O |
|
|
|
|
|
|
+ NH3 |
|
|
|
|
|
||
|
|
CH |
COOH |
|
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
Молочная |
|
|
амид ПВК |
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
кислота |
|
|
NH2 |
CO |
|
NH2 |
уреид ПВК |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
CH3 |
CH |
COOH |
|
|
t, P2O5 |
ангидрид ПВК |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
NH2 – NHC6H5 |
N |
NH |
C6H5 |
|
|
PCl5 |
|
|
|
|
|
|
|
|
|
|
|
|
галогенангидрид ПВК |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
фенилгидразон ПВК |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
43 |
|
|
|
|
|
|
|
|
44 |
Реакции AN и SN протекают легче, чем в отсутствии второй функциональной группы:
|
|
+ 1 |
|
|
|
> |
+I eff |
|
|
|
+ 2 |
+I eff |
|||||||||||
CH3 |
|
|
|
C |
|
|
COOH |
|
CH3 |
|
|
|
|
|
C |
|
|
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 3 |
O |
> CH3 |
|
|
|
|
|
|
|
+ 4 |
O |
||||
CH3 |
|
|
|
C |
|
|
C |
OH |
|
CH2 |
|
|
|
|
C |
OH |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O
!!! Кислотные свойства ПВК выражены значительно сильнее, чем у пропановой кислоты из-
за присутствия ЭА - СО группы.
45
|
б) |
окислительное декарбоксилирование |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
CH3 |
|
|
C |
|
COOH |
+ 1/ |
2 |
O |
CH3 |
|
C |
+CO2 |
||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
In vitro декарбоксилирование протекает при |
||||||||||||||||||||||||
|
нагревании в присутствии H2SO4 (концентрированной |
||||||||||||||||||||||||||
|
или разбавленной) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
H2SO4 разб |
CO2 |
|
+ |
CH3 |
|
|
C |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
CH3 |
|
|
C |
|
|
COOH |
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 конц |
|
CO |
|
|
|
+ |
|
|
|
|
O |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
47 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3). Специфическая реакция – декарбоксилирование (потеря СО2).
а). Ферментативное – в клетках некоторых микроорганизмов (в дрожжах при спиртовом брожении)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
|
COO |
H |
|
E |
|
|
|
O |
+ CO2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
||
|
|
O |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|||
|
|
|
|
|
|
|
|
|
Далее: |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
O [ H ] |
|
|
|
|
||||
|
|
|
|
|
CH3 |
|
|
C |
|
|
|
|
C2H5OH |
|
|
|||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
46 |
|||
ПВКключевое соединение многостадийного процесса углеводного обмена. При клеточном дыхании в присутствии кислорода она в конечном итоге сгорает, превращается в СО2 и Н2О
В отсутствии кислорода под действием ферментов ПВК восстанавливается в молочнуюкислоту.
CH3 |
|
C |
|
|
COOH |
|
H |
|
, E |
CH3 |
|
|
CH |
|
COOH |
||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
OH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Lactic acid |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Молочная кислота накапливается в мышцах при интенсивных физических нагрузках, связанных с большими затратами О2.
48
8

II)Ацетоуксусная кислота
|
|
|
|
|
|
|
- 3 - оксобутановая кислота |
CH3 |
|
C |
|
CH2 |
|
COOH |
образуется в процессе |
|
|
|
|||||
|
|
|
|
|
|
|
Oметаболизма высших жирных кислот.
Декарбоксилирование (достаточно легко)
|
|
|
|
|
|
|
O |
|
|
|
CH3 |
|
C |
|
|
CH3 |
|
CH3 |
|
C |
|
CH2 |
|
C |
|
|
|
|
|
|
|
|
|
+ CO |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
При нормальном обмене АУК в тканях и мышцах последовательно окисляется в СО2, Н2О и выделяющаяся при этом энергия идет на образование АТФ.
В организме у больных сахарным диабетом АУК накапливается в организме наряду с продуктами превращения - гидроксимасляной кислоты
CH3 |
|
C |
|
CH2 |
|
C |
O |
N |
CO2+ H O+ ATФ |
||
|
|
|
|
|
|||||||
OH |
|
||||||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
O
 CH3 C CH3
CH3 C CH3
+ CO2
O
В моче могут содержаться ацетоновые тела:
ацетон,аук, соли аук; которые в клиническом анализе определяют галоформной реакцией.
50
CH3 |
|
C |
|
CH2 |
|
C |
|
O |
|
C2H5 |
-ацетоуксусный эфир |
||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
||
|
!!! |
|
Ацетоуксусный |
эфир |
обладает |
двойственной |
|||||||||||||||||||||
|
природой: кетонной и енольной. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
CH2 |
|
C |
|
O |
|
C2H5 |
|
CH3 |
|
C |
|
CH |
|
|
|
C |
|
O |
|
C2H5 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
|
|
|
|
|
|
|
OH |
|
|
|
|
O |
|
|
|
||||||
|
Кетонная форма - 92.3% |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
Енольная форма - 7.7% |
||||||||||||||||||||
|
|
|
|
tкип = 78º |
|
|
|
|
|
|
|
|
|
|
|
|
tкип = 44º |
|
|
|
|||||||
% содержание кетонных форм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
зависит отрастворителя
51
Докво двойственной природы:Качественная реакция на енольную группу.
CH3 |
|
C |
|
|
CH |
|
C |
|
O |
|
|
C2H5 |
+ |
|
|
FeCl |
- HCl |
|
||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
OH |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
|
CH |
|
|
C |
|
O |
|
|
C2H5 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СИНЕ-ФИОЛЕТОВОЕ ОКРАШИВАНИЕ |
|
|
|||||||||
Cl Cl
52
C H3 |
C |
|
|
|
C H |
|
|
|
|
C |
|
|
|
|
O |
|
|
C H3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
+ |
Br2 (H2O) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
B r |
|
B r |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
C H3 |
C |
|
|
C |
|
|
C |
|
|
O |
|
|
C H3 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
O H |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
H |
|
O |
|
|
|
|
|
|
||||||||||
53
Существование равновесия между кетонной и енольной формами подтверждается этими реакциями. При добавлении избытка FeCl3 появляется сине-фиолетовая окраска. При приливании Br2 фиолетовый цвет исчезает, так как комплекс разрушается, бром присоединяется, но появляется вследствие отщепления FeCl3 (желтого цвета). Через некоторое время окраска вновь постепенно появляется в результате превращения новых порций кетонной формы в енольную.
54
9
|
III) Щавелевоуксусная кислота (ЩУК) |
IV) |
- оксоглутаровая кислота |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
HOOC |
|
C |
C H2 |
C O O H |
-2- оксибутандиовая |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
Относится одновременно |
|
HOOC |
C H2 |
C H2 |
C |
C O O H |
||||
|
|
|
|
|
|
|
к и - оксикислотам |
|
|
||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Образуется в цикле трикарбоновых кислот при окислении |
|
|
|
|
|
O |
|
|||||||||
|
яблочной |
|
кислоты. Для |
нее характерна кето - енольная |
|
|
|
|
|
|
|||||||
|
таутомерия, причем енольная форма более устойчива |
|
|
|
|
|
|
|
|
||||||||
HO |
C |
C |
CH2 |
C |
OH |
HO |
C |
C |
CH |
C |
OH |
|
|
|
|
|
|
|
O |
O |
|
O |
|
|
O |
OH |
|
O |
|
|
|
|
|
|
|
|
Кето - форма |
|
|
|
Енольная форма |
|
|
|
|
|
|
|
|
||||
|
|
20% |
|
|
|
|
80% |
|
|
|
|
|
|
|
|
||
|
Более длинная цепь сопряжения, большая термодинамическая |
|
|
|
|
|
|
|
|||||||||
|
устойчивость. При взаимодействии с ацетилкофеферментом А |
|
|
|
|
|
|
|
|||||||||
|
превращается в лимоннуюкислоту. |
|
|
|
55 |
|
|
|
|
|
|
56 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Спасибо за внимание!
57
10
