
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
Ароматические углеводороды (арены)
Простейшим представителем аренов является бензол:
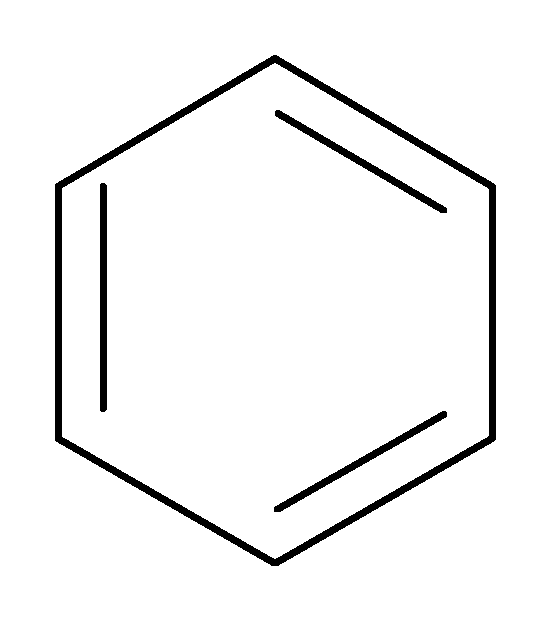
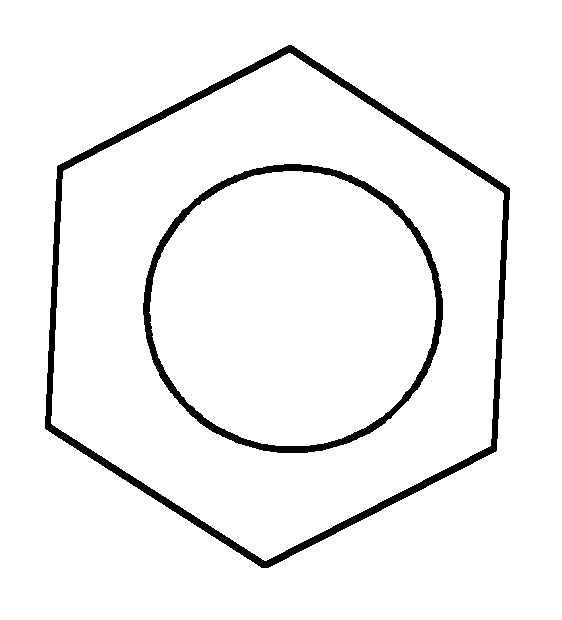
Для бензола и его гомологов выполняются следующие 3 главных критерия ароматичности:
1. Все атомы углерода находятся в sp2 – гибридизации. Следовательно, - остов молекулы плоский, циклический.
2. Число р-электронов соответствует правилу Хюккеля (4n+2). Правило Хюккеля выполняется при любом натуральном числеn= 0, 1, 2 и т.д. В данном случае в бензоле 6электронов (n=1)
3. Единая, замкнутая, сопряженная - система охватывает все атомы цикла.
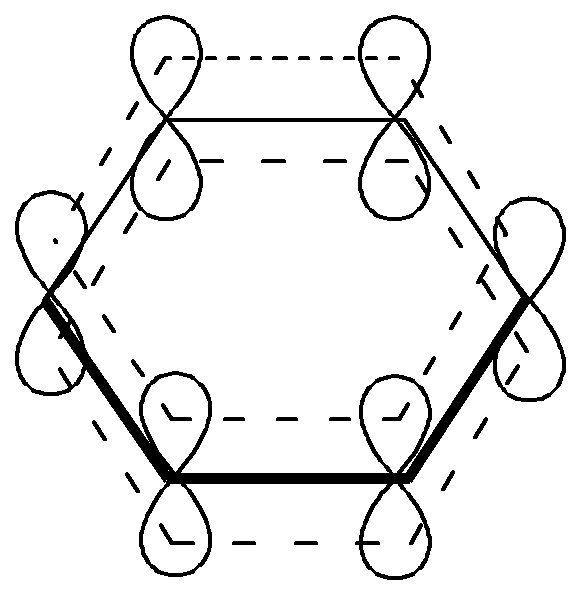
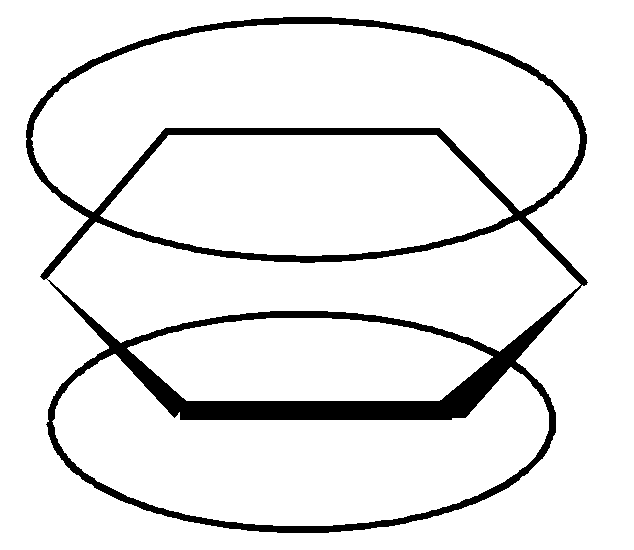
Химические свойства
Ароматические соединения обладают рядом специфических свойств.
Высокая термодинамическая устойчивость.
Устойчивость к действию окислителей.
Реакции электрофильного замещения (SE).
Реакции электрофильного замещения
1. Галогенирование:
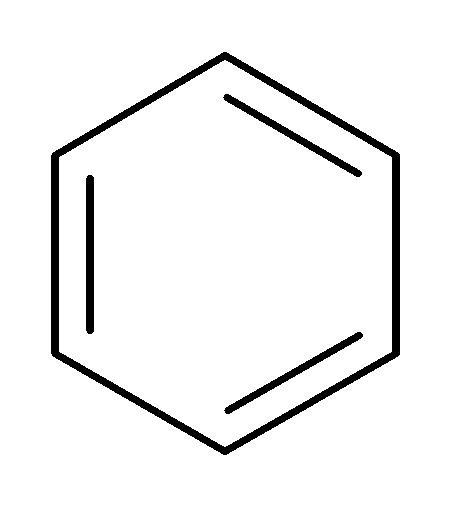
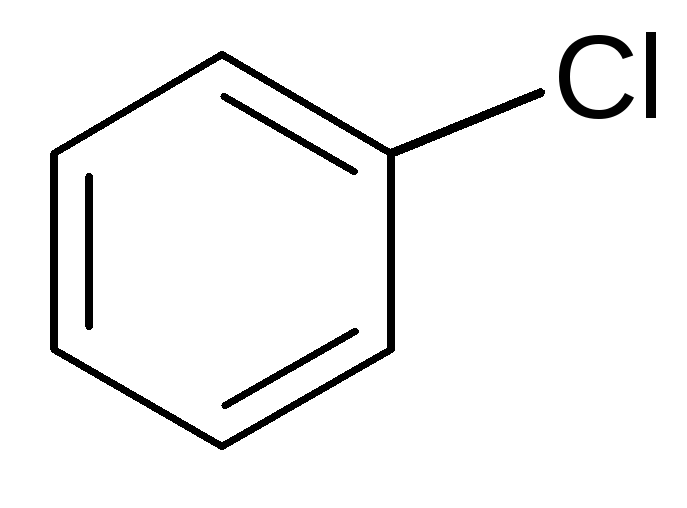 FeCl3
FeCl3
 +Cl2+HCl
+Cl2+HCl
хлорбензол
Роль катализатора (FeCl3,ZnCl2,AlCl3) заключается в поляризации молекулы галогена и выделении электрофилаCl+
 +ClCl-….
FeCl3
Cl+
+ FeCl-4
+ClCl-….
FeCl3
Cl+
+ FeCl-4
2. Нитрование:
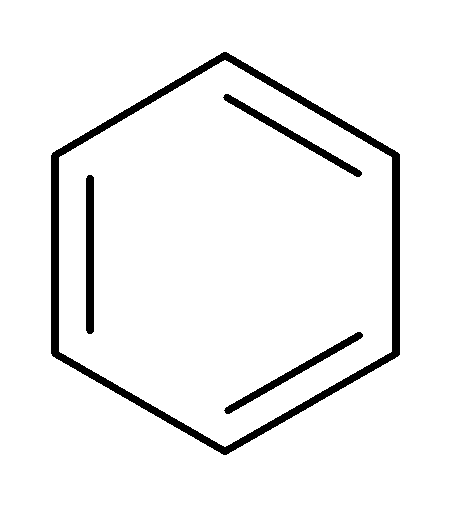
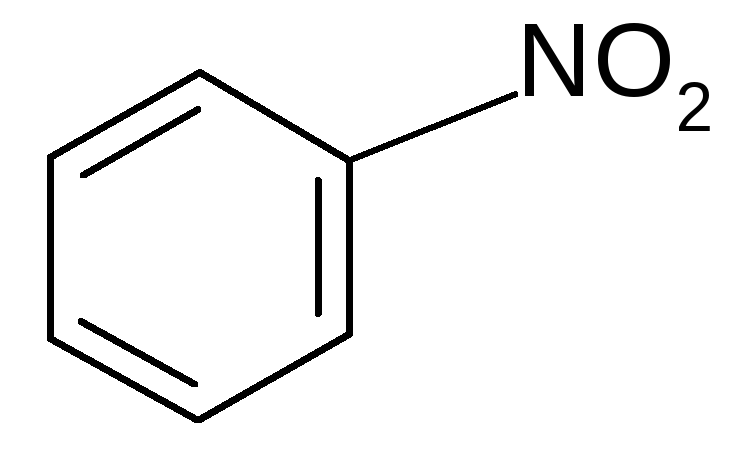 H2SO4
H2SO4
 + -
HO+NO2
+ H2O
+ -
HO+NO2
+ H2O
нитробензол
3. Сульфирование:
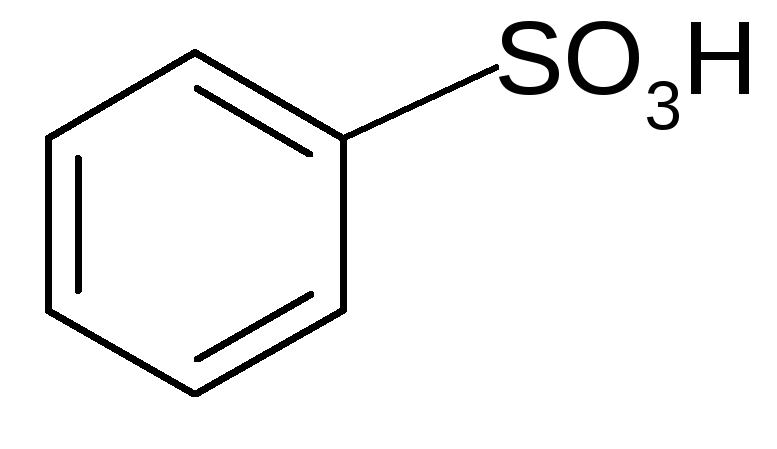
 +-HO-+SO3H+H2O
+-HO-+SO3H+H2O
бензолсульфокислота
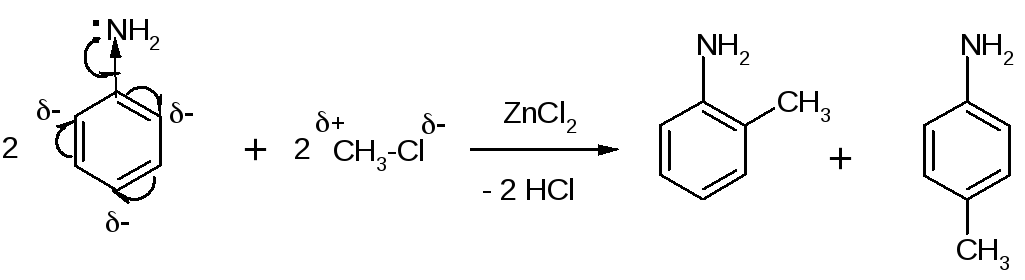
4. Алкилирование:
+-ZnCl2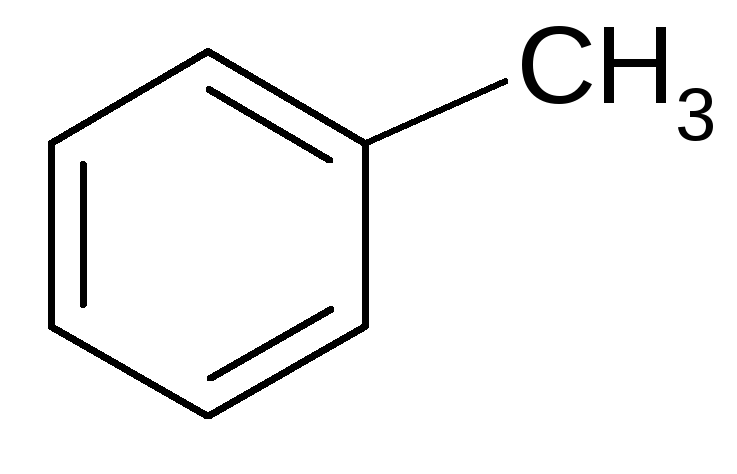
 + СH3 Cl+HCl
+ СH3 Cl+HCl
толуол (метилбензол)
Введение алкильных групп (метильной, изопропильной) усиливает токсическое действие бензола. Гомологи бензола и его производные также вступают в реакции SE, но с разной скоростью. Скорость реакции и ориентация входящего в кольцо заместителя (электрофила) зависят от влияния уже имеющихся заместителей.
Заместители Iрода (NH2,OH,OCH3 и др.) – электронодоноры, увеличивают электронную плотность в кольце, облегчают реакциюSEи ориентируют входящий электрофил в орто- и пара-положения.
![]() Названия
приставок для дизамещенных производных
бензола.
Названия
приставок для дизамещенных производных
бензола.
орто орто
мета мета
пара
Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
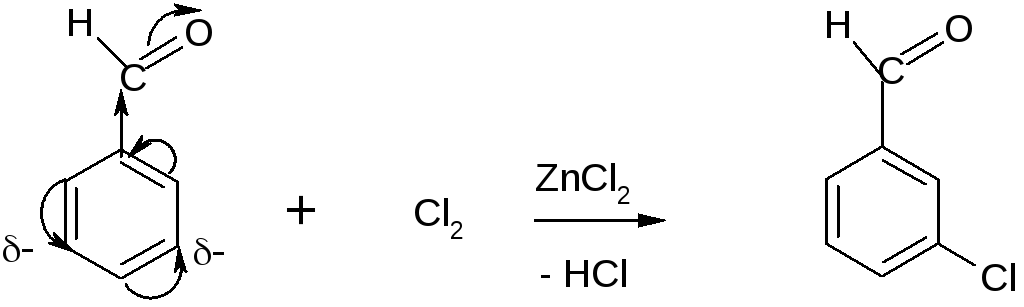
бензальдегид м-хлорбензальдегид
-M, -I(Э.А)
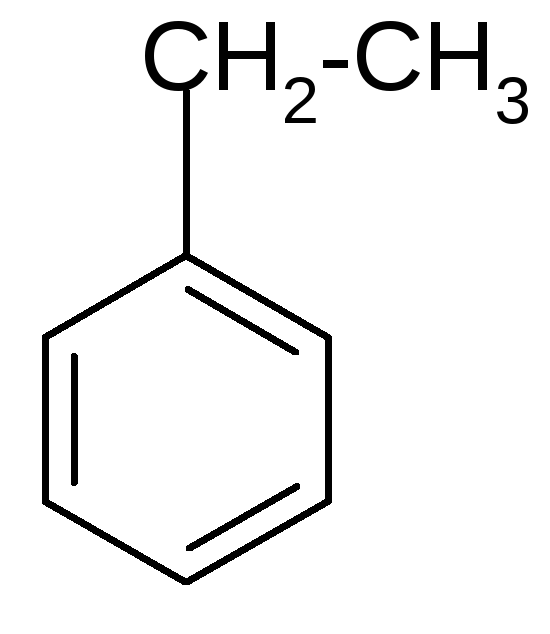
5. Окисление аренов.Бензол устойчив к действию окислителей, но его гомологи, содержащие алифатический радикал, легко окисляются до бензойной кислоты:
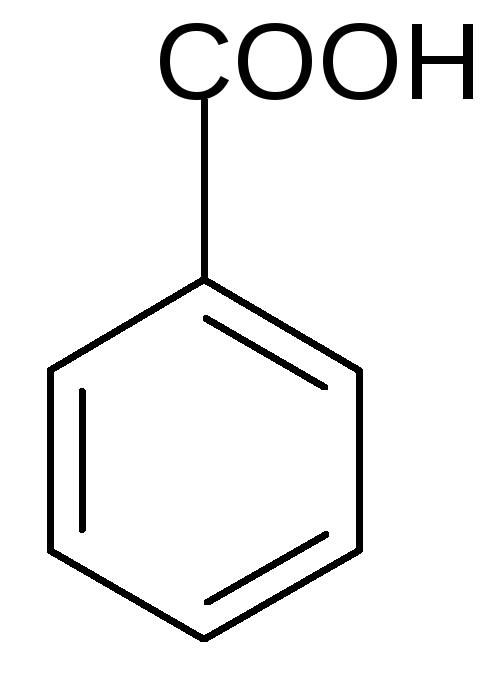
KMnO4
 +CO2+H2O
+CO2+H2O
T0
Какой бы длинной ни была боковая цепь, она окисляется до карбоксильной группы.
Глоссарий
Конфигурация– это пространственное расположение атомов в молекуле.
Конформация– это различные геометрические формы молекулы, возникающие в результате вращения вокруг одинарных связей.
Полярность связи– неравномерное распределение электронной плотности между двумя различными по электроотрицательности связанными атомами.
Электроотрицательность– способность атома в молекуле удерживать валентные электроны.
Поляризуемость– смещение электронов связи под влиянием внешнего электрического поля, в том числе, и другой реагирующей частицы.
Донорно-акцепторная(координационная) связь– это разновидность ковалентной связи, образующаяся за счет пары электронов одного из партнеров по связи.
Водородная связь– это связь между водородом, являющимся положительным концом диполя одной молекулы, и сильно электроотрицательным элементом
этой же или другой молекулы, являющимся отрицательным концом диполя. Природа
связи – диполь-дипольное притяжение.
Делокализация– это распределение электронной плотности по сопряженной системе.
Сопряженные системы – это соединения с чередующимися кратными и простыми связями, или кратными связями и атомами с р-орбиталями.
Индуктивный эффект[I] - это передача электронного влияния заместителя по углеродной цепи.
Мезомерный эффект[M] – это передача электронного влияния заместителей по сопряженной системе.
Ароматическая система– это замкнутая сопряженная система, отвечающая критериям ароматичности.
Гидрофильные группы – это группы, имеющие сродство к Н2О. Они полярны, могут быть заряжены или нейтральны. Например, -+NH3, -COO-, -OH, -SH, и др.
Гидрофобные группы– это группы, не имеющие сродства к воде, неполярные.
Например: -CH3, С6Н5- и др.
Нуклеофильные реагенты (нуклеофилы) – отрицательно заряженные частицы (анионыH-,Cl-,HO-) или нейтральные молекулы с избытком электронной плотности: (NH3,H2Oи др.). ОбозначаютсяNu-или:Nu.
Электрофильные реагенты ( электрофилы)– положительно заряженные частицы (катионы Н+, СН3+, Сl+) или нейтральные молекулы с недостатком электронной плотности (SO3,AlCl3,FeCl3). Обозначаются символом Е+или Е.
