
- •2. Производные моносахаридов, образующиеся в организме (фосфорные эфиры, уроновые кислоты, аминосахара), их биологическое значение.
- •3. Биосинтез хс. Схема процесса. Атеросклероз и связь нарушений метаболизма хс и липопротеинов.
- •4.Минеральные вещества крови (Са, р, Na, k, Fe). Участие в обмене.
- •1. Основные этапы биосинтеза белка. Роль нуклеиновых кислот, активация амк, рабочий цикл рибосомы.
- •2. Гетерополисахариды (классы гликозаминокликанов). Строение, распространение в организме. Биологическая роль.
- •3.Структура ферментов. Активный центр. Механизм обр-ия фермент-субстратного комплекса. Аллостерические участки, их биороль.
- •4. Состав молока и роль в питании растущего ор-ма. Сравнительная оценка состава коровьего и женского молока. Преимущества естественного вскармливания.
- •1. Свойства и биолоическая роль белков. Белки как гидрофильные коллоиды. Реакция осаждения белков, использование реакций осаждения в мед.Практике. Методы очистки и разделения белков.
- •2. Переваривание и всасывание у в жкт. Возрастные особенности. Судьба всосавшихся моносахаридов.
- •3. Понятие об энергии активации. Образование фs-комплекса. Принципы количественного определения активности ф. Единицы активности.
- •4.Содержание и формы билирубина в крови. Диагностическое значение форм билирубина.
- •1. Белки как амфотерные электролиты. Механизм образования заряда. Изоэлектрическая точка белка. Св-ва б в ит.
- •2. Биосинтез и мобилизация гликогена, последовательность реакций. Биол.Роль. Регуляция активности фосфорилазы и гликогенсинтетазы.
- •3.Основные сведения о кинетике ферментативных реакций. Факторы влияющие на скорость р-ий.
- •4. Содержание глюкозы в крови. Возрастные особенности.
- •1.Гидролиз белков. Методы, условия, продукты гидролиза. Определение степени гидролиза. Использование гидролизатов в медицине.
- •2. Анаэробный распад глюкозы. Последовательность р-ий, локализация. Биологическая роль.
- •3. Стероидные гормоны, представители. Механизм действия. Особенности биосинтеза стероидных гормонов.
- •4. Содержание белков в плазме крови, возрастные особенности.
- •2. Роль анаэробного и аэробного распада глюкозы в мышцах. Судьба молочной кислоты.
- •3. Кофакторы и их связь с витаминами. Типичные примеры.
- •4. Содержание остаточного азота в крови. Компоненты остаточного азота.
- •1. Белки. Классификация б. Характеристика сложных б. Хромопотеины, классификация, строение, распространение.
- •2. Аэробное окисление у, схема процесса. Образование пвк из глю, последовательность р-ий. Челночный механизм транспорта водорода.
- •3. Регуляция активности ф. Аллостерические механизмы, ограниченный протеолиз, хим.Модифиация ферментов. Биологическая роль регуляции активности ф.
- •4. Возврастные особенности состава крови (белки, остаточный азот, глюкоза).
- •1. Нуклеопротеины. Современные представления о структуре и функциях нуклеиновых кислот. Продукты их гидролиза.
- •2. Окислительное декарбоксилирование пвк. Последовательность реакций, связь с дыхательной цепью.
- •3. Активаторы и ингибиторы ферментов. Типы ингибирования. Применение ингибиторов в качестве лекарственных средств.
- •4. Минеральные вещества крови. Распределение между плазмой и эритроцитами.
- •1. Днк. Первичная, вторичная и третичная структуры. Биологическая роль днк.
- •2. Цикл трикарбоновых кислот, последовательность реакций, связь с дыхательной цепью. Биологическое значение.
- •3. Классификация ферментов. Важнейшие представители основных классов.
- •4. Содержание Са и р в плазме крови.
- •1. Рнк. Первичная и вторичная структура. Типы рнк, особенности строения, локализация в клетке. Биологическая роль.
- •2. Строение коэнзима а, участие в обмене веществ.
- •3. Энергетический обмен. Стадии катаболизма б, л, у. Источники восстановительных эквивалентов для электрон-транспортной цепи. Роль митохондрий в окислении водорода.
- •4. Изменение содержания белков, остаточного азота, глюкозы при заболеваниях.
- •1. Гликопротеины. Их строение, классификация, представители. Биологическая роль.
- •2. Пентозофосфатный путь окисления глюкозы, основные этапы процесса. Биологическое значение цикла. Наследственные нарушения.
- •3. Митохондриальная цепь окисления кислорода. Образование электрохимического трансмембранного потенциала, его использование.
- •4. Анализ желудочного сока.
- •1. Липопротеины. Их строение, классификация. Состав и функции липопротеинов крови.
- •2. Роль печени в обмене углеводов. Глюконеогенез, субстраты для синтеза, схема реакций.
- •3. Тканевое дыхание, последовательность реакций. Продукция энергии в дыхательной цепи.
- •4. Формы кислотности желудочного сока.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •2. Поддержание постоянства глюкозы в крови. Источники и пути расходования глюкозы в крови. Гипо- и гипергликемия, причины их возникновения.
- •3. Надн-оксидазная система: надн-зависимые дегидрогеназы, флавиновые дг, железосеоцентры. Строение, их роль в транспорте электронов.
- •4. Возрастные особенности желуд сока.
- •1. Заменимые и незаменимые амк. Потребность ор-ма в б в зависимости от возраста. Белковый минимум. Формы баланса азота в организме. Возрастные особенности.
- •2. Биосинтез глюкозы (глюконеогенез). Возможные предшественники, последовательность реакций. Глюкозолактатный цикл (цикл Кори). Физиологическое значение.
- •3. Цикл кислорода дыхательной цепи. Цитохромоксидаза, строение, биологическая роль.
- •4.Физико-химические показатели мочи. Возрастные особенности.
- •1. Переваривание белков в жкт. Промежуточные и конечные продукты гидролиза белков. Использование амк в тканях.
- •2. Сахарный диабет. Характер нарушений обменных процессов при сах.Диабете. Нарушение уранатного пути использования глюкозы как основа нарушений структуры гликозаминогликанов.
- •3. Образование макроэргических соединений в цепи тканевого дыхания. Характеристика процесса с помощью коэффициента р/о. Разобщение окисления и фосфорилирования в дых.Цепи.
- •4. РН мочи в норме и при патологии.
- •1. Процессы превращения аминокислот в толстом кишечнике под влиянием гнилостных бактерий. Обзвреживание проуктов гниения.
- •2. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, фруктоземия, непереносимость дисахаридов. Гликоген- и агликогенозы
- •3. Окислительное и субстратное фосфорилирование в процессе биологического окисления.
- •4. Пигменты мочи и их происхождение.
- •2. Современные данные об активных формах углеводов, жирных кислот и аминокислот.
- •3. Надн – оксидазная система: убихинон, цитохромы. Строение, их роль в транспорте электронов
- •4.Органические вещества мочи, их происхождение.
- •1. Роль нуклеиновых кислот в биосинтезе белка. Характеристика генетического кода. Строение и роль т-рнк.
- •2.Взаимосвязь белкового, углеводного и липидного обменов. Роль ключевых метаболитов глюкозо-6-фосфатов, пировинограной кислоты и ацетил-КоА.
- •3. Образование со2 в процессах биологического окисления. Типы декарбоксилирования в цтк.
- •4. Азотсодержащие вещества мочи. Возрастные особенности.
- •1.Основные этапы биосинтеза белков (активация амк, фазы трансляции, участие рибосом).
- •2. Липиды, классификация и распространение. Химическая природа, свойства и биол.Роль триацилглицеридов.
- •3. Микросомальное и митохондриальное окисление. Сходства и различия. Пути использования кислорода. Токсичность кислорода. Механизмы защиты.
- •4. Содержание мочевой кислоты в крови. Причины гиперурикемии.
- •1.Современные представления о регуляции биосинтеза белка. Регуляция действия генов. Строение и функционирование лактозного оперона. Индукция и репрессия синтеза белков в организме человека.
- •2.Классификация глицеролипидов, хим строение и биологическая роль в организме
- •3. Витамины и их значение в жизнедеятельности человека. Классификация. Участие в обмене веществ.
- •4. Индикан мочи,значение исследования.
- •1.Основные типы превращений аминокислот в тканях(дезаминирование, трансаминирование. Декарбоксилирование)
- •3.Витамин с. Химическая природа, распространение. Участие в обменных процессах.
- •4.Парные соединения мочи.
- •1.Непрямое дезаминирование аминокислот, биологическое значение. Роль глутаматдегидрогеназы. Виды аминотрансфераз, их специфичность.
- •3.Витамин в1. Химическая природа, распространение, участие в обменных процессах.
- •4.Минеральные вещества мочи.
- •1.Образование и обезвреживание аммиака. Биосинтез мочевины, последовательность реакций. Роль печени в мочевинообразовании. Возрастные особенности.
- •3.Витамин в2. Химическая природа, распространение, участие в обменных процессах.
- •4.Реакции на патологические составные части мочи(белок. Глюкоза, кровь, ацетоновые тела). Методы экспресс-диагностики.
- •1.Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в оезвреживании аммиака и синтезе ряда соединений(как донор амидной группы).
- •2.Депонирование и мобилизация жиров в жировой ткани, физиологическое значение. Транспорт и использование жрных кислот, образующихся при мобилизации жиров. Биосинтез и использование кетоновых тел.
- •3.Витамин рр. Химическая природа. Растпространение, участие в обменных процессах.
- •4.Способы определения белка в моче.
- •1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты. Пути выведения.
- •2. Желчные кислоты, строение. Свойства. Участие в переваривании и всасывании липидов. Конъюгация желчных кислот, биологическая роль.
- •3.Витамин в6. Химическая природа, распространение, участие в обменных процессах.
- •4.Глюкозурия и ее причины.
- •1.Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина и меланинов. Наследственные нарушения обмена фенилаланина и тирозина ( фенилкетонурия, алкаптонурия).
- •2.Окисление высших жирных кислот. Последовательность реакций бета-окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью.
- •3.Витамин а. Химическая природа, распространение, участие в обменных процессах.
- •4.Соединительная ткань. Классификация. Клеточные элементы. Основные белки соединительной ткани. Межклеточный матрикс, представление о гликопротеинах соединительной ткани.
- •4.Кетонурия и ее причины.
- •2.Буферные системы крови. Роль буферных систем в поддержании гомеостаза pH. Кислотно-основное состояние. Понятие об ацидозе и алкалозе.
- •3.Функции почек. Транспорт веществ в процессе секреции и реабсорбции. Реабсорбция глюкозы, аминокислот, профильтровавшихся белков. Пороговые и беспороговые вещества.
- •4.Фенилкетонурия, алкаптонурия. Причины их возникновения.
- •Транспорт
2.Буферные системы крови. Роль буферных систем в поддержании гомеостаза pH. Кислотно-основное состояние. Понятие об ацидозе и алкалозе.
В организме кислотообразование преобл.над образованием соед-й основного характера.
Источники Н+ в организме:
1.летучая кислота Н2СО3, в сутки образ.10-20тыс.ммоль СО2 при окислении белков, Ж, У.
2.нелетучие кислоты в сут.образ. 70 ммоль:
- фосфорная при расщепл.орг.фосфатов(нуклеотидов, ФЛ, фосфопротеидов)
-серная, соляная при окислении Б
3.орг.к-ты:молочная, кетоновые тела, ПВК и др.
рН удерживается на слабощелочном уровне благодаря участию буф.с-м и физиологическому контролю(выделит.ф.почек и дыхат.ф.легких)
Уравнение Гендерсона-Хессельбаха: pH = pKa + lg [акц.протонов]/[донор протонов].
( Соль) ( кислота)
Любая буф.с-ма состоит из сопряженной кислотно-основной пары: донор+акцептор протонов.
Буферная емкость: зависит от абсолютных концентраций компонентов буфера.
Бикарбонатная.
10%буф.емкости крови.
![]()
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната иводу. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основногоравновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких.
NaHCO3 + H+ → Na+ + H2CO3
Реабс.в почках ↓карбоангидраза
СО2 + Н2О
↓увеличение вентиляции легких
Фосфатная представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донорпротонов) и иона НРО42– (акцептор протонов):
![]() Фосфатная буферная
система составляет
всего лишь 1% от буферной емкости крови.
Во
внеклеточной жидкости,
в том числе в крови,
соотношение [НРО42–]:
[Н2РО4–]
составляет 4:1. Буферное действие фосфатной
системы основано на возможности
связывания водородных ионов ионами НРО42– с
образованием Н2РО4– (Н+ +
+ НРО42– —>
Н2РО4–),
а также ионов ОН– с ионами Н2РО4– (ОН– +
+ Н2 Р
О4– —>
HPO42–+
H2O).
Буферная пара (Н2РО4––НРО42–)
способна оказывать влияние при изменениях
рН в интервале от 6,1 до 7,7 и может
обеспечивать определенную буферную
емкость внутриклеточной жидкости,
величина рН которой в пределах 6,9–7,4.
В крови максимальная
емкость фосфатного буфера проявляется
вблизи значения рН 7,2.
Фосфатная буферная
система составляет
всего лишь 1% от буферной емкости крови.
Во
внеклеточной жидкости,
в том числе в крови,
соотношение [НРО42–]:
[Н2РО4–]
составляет 4:1. Буферное действие фосфатной
системы основано на возможности
связывания водородных ионов ионами НРО42– с
образованием Н2РО4– (Н+ +
+ НРО42– —>
Н2РО4–),
а также ионов ОН– с ионами Н2РО4– (ОН– +
+ Н2 Р
О4– —>
HPO42–+
H2O).
Буферная пара (Н2РО4––НРО42–)
способна оказывать влияние при изменениях
рН в интервале от 6,1 до 7,7 и может
обеспечивать определенную буферную
емкость внутриклеточной жидкости,
величина рН которой в пределах 6,9–7,4.
В крови максимальная
емкость фосфатного буфера проявляется
вблизи значения рН 7,2.
1 и 2 – выводящие.
Белковая имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донорпротонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донорпротонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое.
Механизм действия:
- в тканях: Н2О + СО2(карбоангидраза) —>Н2СО3—>Н+ + НСО3-(диффундирует в плазму крови)
КНвО2 —>КНв + 4О2
КНв + 2Н+ —> ННв + 2К+ (К-гемоглобин неитрализует ионы Н+)
- в легких: ННв + 4О2 —>2Н+ + НвО2
2Н+ + НвО2 + 2К+ + 2НСО3- —>КНвО2 + 2Н2СО3(карбоангидраза) —>Н2О + 2СО2
рН и концентрация СО2 влияют на освобождение и связывание О2 немоглобином – эфф.Бора.
Повышение концентрации протонов, СО2, способствует освобождению О2, а повышение концентрации О2 стимулирует высвобождение СО2 и протонов.
Гормоны надпочечников. Глюкокортикоиды и минералокортикоиды. Химическое строение и участие в обменных процессах.
Кортизол/гидрокортизон – гормон пучковой зоны коры надпочечников. Глюкокортикоид/кортикостероид.
Влияние на обмен у/в, белков, жиров и нукл.к-т. Стимулирует образование глю в печени, усил.глюконеогенез, синтез глк в печени, и уменьш.потребление глю периферическими тканями. Липолиз в конечностях и липогенез в теле.
Альдостерон - клубочковая зона коры. Минералокортикоид.
Гл.образом регулир.обмен натрия, калия, хлора, воды. Способств. Удержанию натрия и хлора в организме и выведению с мочой ионов калия.
Нарушения:
Первичная недостаточность – б.Аддисона(поражение коры). Снижение массы тела, слабость, снижение аппетита, тошнота, снижение АД, «бронзовая болезнь»
Вторичная – отсутствует гиперпигментация кожи, -//-.
Врожденная гиперплазия надпочечников. Нарушение синтеза кортизола – усиление роста тела, раннее половое созревание у мальчиков и муж.пол.признаки у девочек.
Гипекортицизм(при опуходях гипофиза.). Гипергликемия, уменьш.толерантности к глю, уменьш.мыш.массы, истончение кожи, остеопороз.
Гематурия и гемоглобинурия, их причины.
Гематурия:
Ренальная – поражение эпителия канальцев или интерстиция почки
Постренальная – травматическое повреждение мочевыводящих путей(например, отхождение камней)
Выделяют следующие формы гемоглобинурий: 1. Ночная гемоглобинурия Маркиафава. 2. Токсические гемоглобинурии. 3. Маршевая гемоглобинурия (редкое заболевание).
После долгих переходов (маршей) может наблюдаться типичная гемоглобинурия. Всегда имеется выраженный поясничный лордоз. Других патологических явлений нет. Гемоглобинурия через несколько часов прекращается. Особого клинического значения эта форма не имеет.
4. Холодовая гемоглобинурия: при пароксизмальной холодовой гемоглобинурии, в большинстве случаев после длительного воздействия холода (купание в холодной воде, реже только холодный наружный воздух), наблюдается гемоглобинурия.
Билет№31
Биосинтез РНК. Процессинг матричной и транспортной РНК. Обратная транскрипция, биологическая роль.
Транскрипция – синтез РНК на матрице ДНК.
Последовательность дезоксирибонуклеотидов в гене ДНК переписывается в виде комплементарной последовательности РНК.
Кодирующая – с которой пишется.
Транскриптон – участок ДНК, на котором происходит синтез РНК: *стр-рные гены, кодирующие белки, * промотор, * терминатор.
Синтез РНК катализирует ДНК-зависимая РНК-полимераза. Холофермент РНК-полимеразы состоит из 5 субъединиц: α, α’, β, β’, δ. РНК-полимераза без δ – корфермент(ядро). Субъединица δ нужна для узнавания промотора и связывания с ним.
Этапы транскрипции:
Связывание РНК-полимеразы с ДНК
Холофермент РНК-пол.двигается по ДНК, пока не найдет промотор, образуя с ним сначала закрытый промоторный комплекс. Чтобы информация стала открытой, он должен стать открытым. Расплетается с участием δ. Связь РНК-пол.с промотором становится прочнее.
Инициация
Состоит в образовании первых звеньев в цепи РНК. Субстраты и источники Е – макроэргические рибонуклеозидтрифосфаты(АТФ, ГТФ, УТФ, ЦТФ)
РНК-полимеразы не треб.затравки(в отл.от ДНК-пол). Первый нуклеотид вход.в состав цепи в виде трифосфата;следующий присоед.к его 3’-группе.
Синтез РНК идет комплементарно и антипараллельно кодирующей цепи РНК. Когда образована цепь из 3-9 нуклеотидов, дельта-субъединица отщепляется.
Стадию элог\нгации и терминации катализирует корфермент.
На стадии элонгации расплетено 18 пар нуклеотидов;12 из них образуют гибридную спираль с растущей ДНК.
РНК-полимераза двигается по ДНК; впереди нее водород.связи разрываются, сзади замыкаются.
РНК-пол.не проверяет правильность синтеза;ошибки чаще, чем при ДНК.
Терминация
Участок ДНК перед терминатором богат цитозиновыми и гуаниловыми нуклеотидами.
Шпилька останавливает ДНК-полимеразу;транскрипция заканчивается. РНК-полимераза и синтезированная РНК отделяются от ДНК. Терминации способствуют белки-факторы терминации.
Транскрипция идет консервативно – ДНК-матрица полностью сохраняется; РНК синтезируется заново.
РНК-пол.у эукариот:
РНК-пол.1 – синт.в ядрышке рибосомальную РНК
РНК-пол.2 – синт. Информационную РНК
РНК-пол.3 – транспортные и др.РНК
Синтезированная РНК(первичный транскрипт) не может выполнять свою биологич.ф., т.к. является незрелой. Для ее созревания нужен процессинг
У прокариот не происходит. Транляция начинается еще до завершения транскрипции
У прокариот включает модификацию 5’-конца(кэпирование) и 3’-конца(полиаденилирование)
Обратная транскрипция.
Синтез ДНК на матрице РНК.
Характерна для ретровирусов. Имеют фермент ревертазу(обратная транскриптаза). Используют в качестве матрицы как ДНК, так и РНК.
В клетке хозяина ревертаза вируса синтезирует цепь ДНК, комплементарную матрице РНК. Затем расщепляет всю вирусную РНК. На основе ДНК происходит синтез второй ДНК. Далее двойная ДНК встраивается в кл-хозяина.
Гемоглобин, строение и свойства. Возрастные особенности. Понятие об аномальных гемоглобинах.
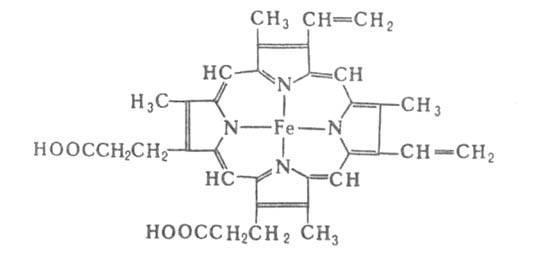
В крови 130-160г/л(у муж.132-164, жен.115-145г/л), в эритр.300-400г/л(в ед.СИ)
Нв – хромопротеин(не энзимный гемопротеин). Небелковая часть – гемм, и белковая – глобин.
Имеет 4 уровня стр-ры:
первичная – послед-ть АК в п/п цепях, попарно одикановых. Так. НвА(взрос) имеет 2альфа и 2бета-цепи. Альфа-цепь имеент 141 АК, бета – 146, и вся мол-ла =574АК.
Спиральзация п/п цепей. Мол-ла Нв спирализована на 80%, и представляет правозакрученную спираль. Альфа-цепь имеет 7 спиральных участков., бета – 8. Спир.участки обознач.буквами лат.алф. – А,В,С…Н. Они чередуются с неспирализованными, обозначаемыми двумя буквами спиралей, между кот.они находятся(АВ,ВС)
П/п цепи образ.множнство связей. В отдельных местах спиральные участки делают изгибы, повороты, образуя третич.стр-ру:
упаковка спирали в простр-ве. При этом гемм оказ-ся окутанным в слое белка. При упаковке цепей глобина неполярные АК оказ-ся внутри(окружая гем) придавая высокую устойчивость железу гемма(защищ.от окисл-я)
Каждая п/п цепь связана с гемом: гемм+глобин = субъед-ца/протомер
Связь осущ.через железо гемма и атом азота гистидина(в п/п цепи). п/п цепи образ.для гемма карманы, окруженные неполярными АК и ужерживают. Железо гемма имеет координационное число 6: 4 связи направлены к 4 атомам азота пиррольных колец гемма, 5я – к атому азота гистидина в п/п цепи, 6я – на связь с О2(в дезоксиНв она свободна).
ассоциация протомеров, ориентированных в пространстве определенным образом относительно друг друга. Вся мол-ла Нв имеет 4 гема и 4 глобина(п/п цепи)
Между субъед-цами возникает множ-во контактов – α1-α2, β1-β2, α 1-β1, α 2-β2…
Эти контакты удерживают м-лу Нв в виде димера и тетрамера.
Субъед-цы ассоциированы ак, что в центре образ.впадина – центр.полость, в к-рой фиксируются орг.фосфаты.
Свойства:
*транспорт О2 к тканям (через железо гемма-простетич.гр)
*транспорт СО2 из тканей (через своб.амынные гр.АК-белк.часть)
Высокая р-римость СО2(в 20 раз больше чем у О2)создает благоприят.усл.для транспорта, к-рый осущ.своб.аминн.гр.глобина – карбаминоНв.
*обеспеч.поддержание постоянства рН, входя в состав гемоглобиновой буф.с-мы
*выполн.антитоксич.ф. – связ.цианиды – цианметНв, монооксид углерода – карбоксиНв.
Гетерогенность Нв.
Онтогенетическая/созревания.
Смена типов зависит от:
-особенностей снабжения тканей О2. у эмбриона источник – интерстиц.жидкость, у плода – плацента, у новорожденного – легкие.
- смены органов кроветворения
1. эмбриональные Нв. Их синтез идет с 2х недель эмбр.развития;ощутимые кол-ва опр-ся в 8 нед.
(Gower-1(эпсилон2,эпсилон2), Gower-2(эпсилон4), Portland-1(гамма2,епсилон2))
Синтез прекращ.к 14 нед.(образование плаценты)
фетальные. HbF(альфа2,гамма2)-гетерогенен(3-5компонентов)
свойства: лучше р-рим, чем НвА;высокая скорость окисления железа гемма – легко происх.образоване метНв. Устойчив к денатурации щелочью. Обладают более высоким сродством к О2. имеет специфич.спектр поглощения. Высокая скорость при электрофорезе. Синтезируется с 14нед.внутриутр.разв.
возрастные изменения: н/р 80%,3мес 40%,6мес 23%,9мес 10%, 1год 4-5%, 3года 1,5%, больше3лет 1%.
2)Нв взрослого типа.
Синтез НвА начинается у эмбр.на 8-11нед., идет медленно и у н/р сост.20%от общего. 1мес 43%, 5мес 75%.
При комплексировании Нв с у/в. Конмлекс аминогр.с альд.гр. глю образ.А1с, образуется альдиминная связь, к-рая при длительной гликемии превращ.в стойкую кетоаминную с образованием гликированных Нв.
