
Решение задач на р-ры
.docВАРИАНТ №1
1. Какое количество вещества A надо растворить в m2 г воды, чтобы получить ω%-ный раствор A?
Решение.
ω
![]() ,
откуда
,
откуда
![]() ,
,
где ω – массовая доля A, %; m1 и m2 – физические массы A и воды, г.
![]() ,
,
где n1 – искомое количество вещества A, моль; M – молярная масса A, г/моль.
2. Oсмотическое давление водного раствора, в V мл которого содержится m г неэлектролита A, при t °C равно pоcм. кПа. Найдите молекулярную массу неэлектролита.
Решение.
T = t + 273,
где T – температура, К; t – температура,°C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
=
с∙R∙T,
откуда с
![]() ,
,
где
c
– молярная концентрация A,
моль/л;
pоcм.
–
осмотическое давление раствора, кПа;
R
= 8,31
![]() –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
с![]() ,
откуда
,
откуда
![]()
где M – молярная масса A, г/моль; m – физическая масса A, г; 1000 мл/л – пересчетный коэффициент; V – объем раствора, мл.
![]() ,
,
где M r – искомая молекулярная масса A, а.е.м.
3. На сколько понижено давление насыщенного пара воды над ω%-ным раствором неэлектролита A по сравнению с чистой водой при 100 °C? Давление насыщенного пара над чистой водой при температуре кипения равно атмосферному.
Решение.
m1 = ω, m2 = 100 – ω,
где m1 и m2 – физические массы A и воды в 100 г раствора, г; ω – массовая доля A, %.
![]() ,
,
где n1 и n2 – количества вещества A и воды в 100 г раствора, моль; M1 и M2 – молярные массы A и воды, г/моль.
![]() ,
,
где χ – мольная доля A, доли единицы.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
откуда
,
откуда
![]() ,
,
где Δp – искомое понижение давление насыщенного пара над раствором, атм; p0 – давление насыщенного пара над чистой водой, атм.
4. Растворитель замерзает при tзам. р-ля °C, а его криоскопическая константа составляет Кк K∙кг/моль. При какой температуре замерзнет раствор, содержащий n моль неэлектролита A в m г растворителя?
Решение.
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг; n – количество вещества A, моль; 1000 г/кг – пересчетный коэффициент m – физическая масса растворителя, г.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам = Кк∙cm,
где Тзам – понижение температуры замерзания раствора относительно растворителя, К; Кк – криоскопическая константа растворителя, К·кг/моль.
tзам. р-ра = tзам. р-ля – Тзам,
где tзам. р-ра – искомая температура замерзания раствора, °C; tзам. р-ля – температура замерзания растворителя, °C.
ВАРИАНТ №2
1. В V1 л ω1%-ного раствора газа A (плотность раствора равна ρр-ра г/см3) дополнительно растворили V2 л A (н.у.). Вычислите массовую долю A в полученном растворе.
Решение.
m = V1∙1000∙ρр-ра,
где m – масса исходного раствора, г; V1 – объем исходного раствора, л; 1000 см3/л – пересчетный коэффициент; ρр-ра – плотность исходного раствора, г/см3.
m1
![]() ,
,
где m1 – физическая масса A в исходном растворе, г; ω1 – массовая доля A в исходном растворе, %; 100 – пересчетный коэффициент от процентов к долям единицы.
m2
![]() ,
,
где m2 – физическая масса дополнительно растворенного A, г; V2 – объем дополнительно растворенного A при н.у., л; VM – молярный объем газа при н.у., л/моль; M – молярная масса А, г/моль.
ω2
![]() ,
,
где ω2 – искомая массовая доля A в полученном растворе, доли единицы.
2. Чему равна массовая доля неэлектролита A в растворе (плотность раствора равна ρр-ра г/мл), осмотическое давление которого при t °C составляет pоcм. кПа?
Решение.
T = t + 273,
где T – температура, К; t – температура, °C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
=
с∙R∙T,
откуда с
![]() ,
,
где
c
– молярная концентрация A,
моль/л;
pоcм.
–
осмотическое давление раствора, кПа;
R
= 8,31
![]() –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
mр-ра = 1000∙ρр-ра,
где mр-ра – масса 1 л раствора, г; 1000 мл/л – пересчетный коэффициент; ρр-ра – плотность раствора, г/мл.
m = с⋅1 л⋅M,
где m – масса A в 1 л раствора, г; M – молярная масса А, г/моль.
ω
![]() ,
,
где ω – искомая массовая доля, доли единицы.
3. Давление насыщенного пара над чистым растворителем В при t °C равно p0 кПа. Найдите моляльную концентрацию неэлектролита A в растворе, над которым при этой температуре давление насыщенного пара В равно p кПа.
Решение.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
,
где p0 и p – давления насыщенного пара над чистым В и над раствором, кПа; χ – мольная доля A, доли единицы.
![]() ,
откуда
,
откуда
![]() ,
,
где n1 и n2 – количества вещества A и В, моль.
cm
![]() ,
,
где cm – искомая моляльная концентрация A, моль/кг; m2 – физическая масса В, кг; M – молярная масса В, кг/моль.
4. Определите температуру замерзания ω%-ного водного раствора неэлектролита A. Криоскопическая константа воды равна Кк K∙кг/моль.
Решение.
![]()
где m1 – физическая масса A в 100 г раствора, г; ω – массовая доля A, %.
![]()
где n – количество вещества A в 100 г раствора, моль; M – молярная масса A, г/моль.
![]() ,
,
где m – физическая масса воды в 100 г раствора, кг; 1000 г/кг – пересчетный коэффициент.
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам = Кк∙cm,
где Тзам – понижение температуры замерзания раствора относительно воды, К; Кк – криоскопическая константа воды, К·кг/моль.
tзам. р-ра = tзам. воды – Тзам,
где tзам. р-ра – искомая температура замерзания раствора, °C; tзам. воды – температура замерзания воды, °C.
ВАРИАНТ №3
1. Колба заполнена газом при н.у. Затем колбу заполнили жидкостью, в которой полностью растворился газ. Найдите молярную концентрацию в полученном растворе.
Решение.
c
![]()
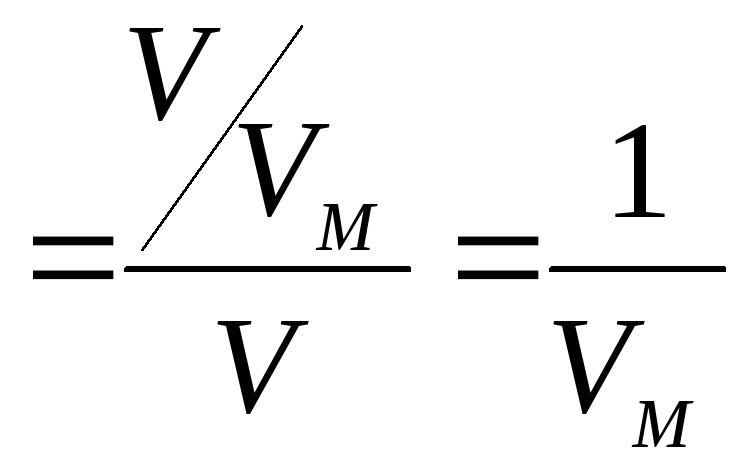 ,
,
где c – искомая молярная концентрация газа, моль/л; n – количество вещества газа, моль; V – объем колбы, л; VM – молярный объем газа при н.у., л/моль.
2. Чему равно осмотическое давление c M раствора неэлектролита при t °C?
Решение.
T = t + 273,
где T – температура, К; t – температура, °C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм. = с∙R∙T,
где
pоcм.
–
осмотическое давление раствора, кПа;
c
– молярная концентрация неэлектролита,
моль/л; R
= 8,31
![]() –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
3. Давление насыщенного пара над чистой водой при некоторой температуре равно p0 мм рт. ст. Найдите отношение масс воды m1 и неэлектролита A m2, необходимых для приготовления раствора, над которым при этой температуре давление насыщенного пара воды равно p мм рт. ст.
Решение.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
,
где p0 и p – давления насыщенного пара над чистой водой и над раствором, мм рт. ст.; χ – мольная доля A, доли единицы.
![]() ,
откуда
,
откуда
![]() ,
,
где n1 и n2 – количества вещества воды и A, моль.
![]() ,
,
где m1 и m2 – физические массы воды и А, г; M1 и M2 – молярные массы воды и А, г/моль.
4. Сколько г неэлектролита A надо растворить в V л воды, чтобы приготовленный антифриз замерзал при tзам. р-ра °C? Криоскопическая константа воды равна Кк K∙кг/моль.
Решение.
Тзам = tзам. воды – tзам. р-ра,
где Тзам – понижение температуры замерзания раствора относительно воды, К; tзам. воды – температура замерзания воды, °C; tзам. р-ра – температура замерзания раствора, °C.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам
= Кк∙cm
, откуда
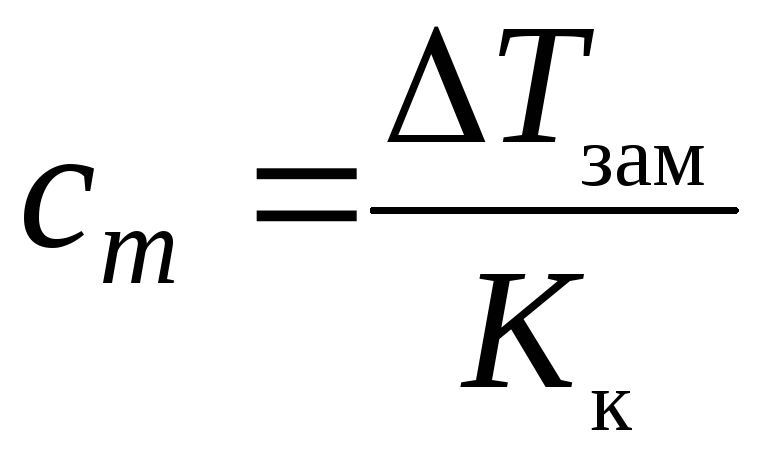 ,
,
где cm – моляльная концентрация A, моль/кг; Кк – криоскопическая константа растворителя, К·кг/моль.
cm
![]() ,
откуда n
= cm∙V∙ρ,
,
откуда n
= cm∙V∙ρ,
где n – количество вещества A, моль; m2 – физическая масса воды, кг; V – объем воды, л; ρ – плотность воды, кг/л.
m1 = n∙M,
где m1 – искомая физическая масса A, г; M – молярная масса A, г/моль.
ВАРИАНТ №4
1. В V мл воды растворили m1 г вещества A. Найдите массовую и мольную доли А в полученном растворе.
Решение.
m2 = V∙ρ,
где m2 – физическая масса воды, г; V – объем воды, мл; ρ – плотность воды, г/мл.
![]() ,
,
где ω – искомая массовая доля A, доли единицы; m1 – физическая масса А, г.
![]() ,
,
где n1 и n2 – количества вещества A и воды, моль; M1 и M2 – молярные массы A и воды, г/моль.
![]() ,
,
где χ – искомая мольная доля A, доли единицы.
2. Oсмотическое давление водного раствора неэлектролита А при t °C равно pоcм. Па. Найдите молярную концентрацию А.
Решение.
T = t + 273,
где T – температура, К; t – температура, °C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
=
1000·с∙R∙T,
откуда с
![]() ,
,
где
c
– искомая молярная концентрация A,
моль/л;
pоcм.
–
осмотическое давление раствора, Па;
R
= 8,31
![]() –
универсальная газовая постоянная. 1000
Па/кПа – пересчетный коэффициент;
–
универсальная газовая постоянная. 1000
Па/кПа – пересчетный коэффициент;
3. Давление насыщенного пара над раствором неэлектролита A понижено сравнительно с чистой водой на χ %. Найдите массовую долю A в растворе.
Решение.
Согласно первому закону Рауля для растворов неэлектролитов и определению мольной доли
![]() ,
откуда
,
откуда
![]() ,
,
где n1 и n2 – количества вещества воды и A, моль; χ – мольная доля A, %; 100 – пересчетный коэффициент от процентов к долям.
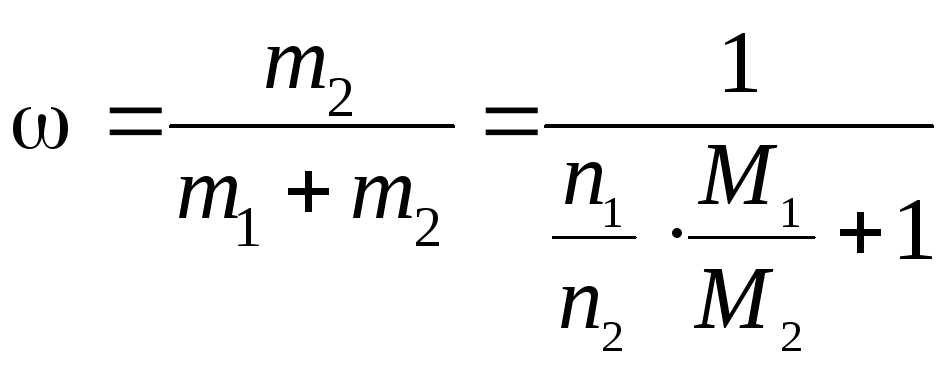 ,
,
где ω – искомая массовая доля A, доли единицы; m1 и m2 – физические массы воды и А, г; M1 и M2 – молярные массы воды и А, г/моль.
4. Раствор, содержащий m1 мг неэлектролита A в m2 г растворителя, замерзает при tзам. р-ра °C. Криоскопическая константа растворителя равна Кк K∙кг/моль, а температура его замерзания составляет tзам. р-ля °C. Найдите молярную массу А.
Решение.
Тзам = tзам. р-ля – tзам. р-ра,
где Тзам – понижение температуры замерзания раствора относительно растворителя, К; tзам. р-ля – температура замерзания растворителя, °C; tзам. р-ра – температура замерзания раствора, °C.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам
= Кк∙cm,
откуда
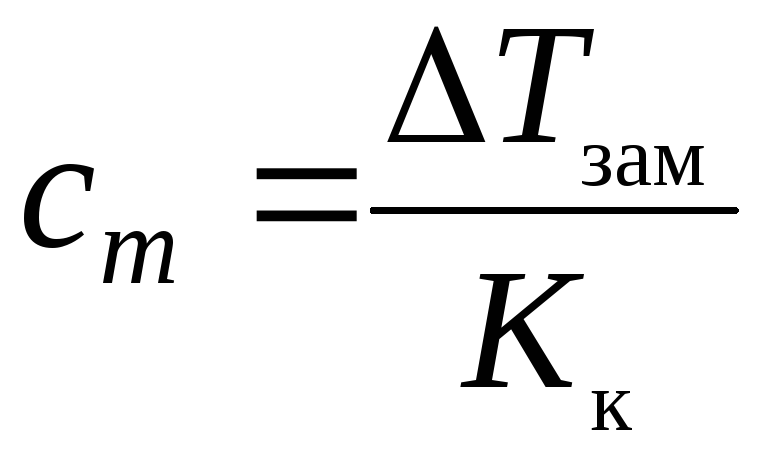 ,
,
где cm – моляльная концентрация A, моль/кг; Кк – криоскопическая константа растворителя, К·кг/моль.
cm
![]() ,
откуда
,
откуда
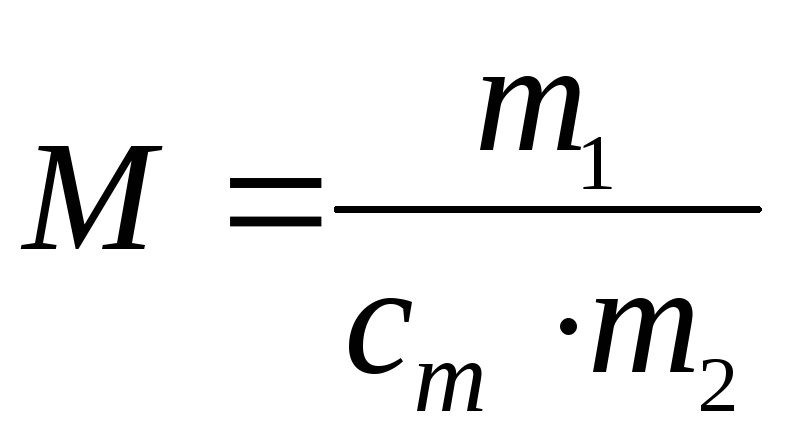 ,
,
где M – искомая молярная масса A, г/моль; n – количество вещества A, моль; 1000 г/кг и 1000 мг/г – пересчетные коэффициенты; m2 – физическая масса растворителя, г; m1 – физическая масса А, мг.
ВАРИАНТ №5
1. Найдите массовую долю кислоты HaЭOb в водном растворе, в котором числа атомов водорода и кислорода равны между собой.
Решение.
Если равны числа атомов, то равны и количества вещества элементов:
![]() a∙n1
+ 2∙n2
= n(O)
=
a∙n1
+ 2∙n2
= n(O)
=
![]() b∙n1
+ n2,
b∙n1
+ n2,
откуда
![]() ,
,
где
n(H)
–
количество вещества H,
моль;
![]() –
количество вещества H
в кислоте, моль;
–
количество вещества H
в кислоте, моль;
![]() –
количество вещества H
в воде, моль; n1
и n2
–
количества вещества кислоты и воды,
моль; n(O)
–
количество вещества O,
моль;
–
количество вещества H
в воде, моль; n1
и n2
–
количества вещества кислоты и воды,
моль; n(O)
–
количество вещества O,
моль;
![]() –
количество вещества O
в кислоте, моль;
–
количество вещества O
в кислоте, моль;
![]() –
количество вещества O
в воде, моль.
–
количество вещества O
в воде, моль.
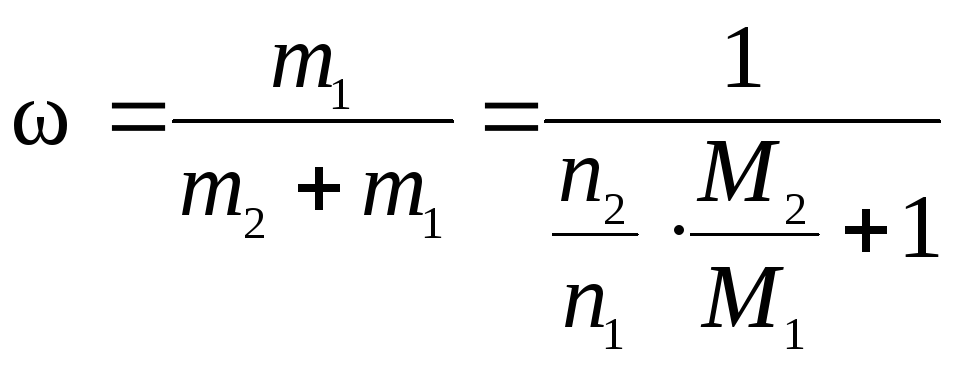 ,
,
где ω – искомая массовая доля HaЭOb, доли единицы; m1 и m2 – физические массы HaЭOb и воды, г; M1 и M2 – молярные массы HaЭOb и воды, г/моль.
2. Oсмотическое давление водного раствора неэлектролита при t1 °C равно pоcм.,1 кПа. Найдите его при t2 °C.
Решение.
T1 = t1 + 273, T2 = t2 + 273,
где T1 и T2 – температуры, К; t1 и t2 – температуры, °C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.,1
=
с∙R∙T1,
pоcм.,2
=
с∙R∙T2,
откуда pоcм.,2![]() ,
,
где pоcм.,1 и pоcм.,2 – осмотические давления раствора при t1 и t2 °C, кПа.
3. Давление насыщенного пара над раствором неэлектролита понижено сравнительно с чистой водой на χ %. Найдите соотношение между количеством вещества воды n1 и количеством вещества неэлектролита n2 в растворе.
Решение.
Согласно первому закону Рауля для растворов неэлектролитов и определению мольной доли
![]() ,
откуда
,
откуда
![]() ,
,
где
![]() – искомое
соотношение; 100 – пересчетный коэффициент
от процентов к долям; χ
– мольная
доля A,
%.
– искомое
соотношение; 100 – пересчетный коэффициент
от процентов к долям; χ
– мольная
доля A,
%.
4. Для приготовления антифриза на V1 л воды взято V2 л неэлектролита A (плотность A равна ρ2 г/мл). Криоскопическая константа воды равна Кк K∙кг/моль. Найдите температуру замерзания антифриза.
Решение.
m1 = V1∙ρ1,
где m1 – физическая масса воды, кг; V1 – объем воды, л; ρ1 – плотность воды, кг/л.
m2 =1000∙V2∙ρ2,
где m2 – физическая масса А, г; 1000 мл/л – пересчетный коэффициент; V2 – объем А, л; ρ2 – плотность А, г/мл.
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг; n – количество вещества A, моль; M – молярная масса A, г/моль.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам = Кк∙cm,
где Тзам – понижение температуры замерзания раствора относительно воды, К; Кк – криоскопическая константа воды, К·кг/моль.
tзам. р-ра = tзам. воды – Тзам,
где tзам. р-ра – искомая температура замерзания раствора (антифриза), °C; tзам. воды – температура замерзания воды, °C.
ВАРИАНТ №6
1. Найдите массу вещества А в V л его водного раствора с массовой долей ω % (плотность раствора ρ г/мл). Определите молярную концентрацию А.
Решение.
m = 1000∙V∙ρ,
где m – физическая масса раствора, г; 1000 мл/л – пересчетный коэффициент; V – объем раствора, л; ρ – плотность раствора, г/мл.
![]() ,
откуда
,
откуда
![]()
где ω – массовая доля А, %; m1 – физическая масса А, г.
c
![]()
![]() ,
,
где c – искомая молярная концентрация, моль/л; n – количество вещества A, моль; M – молярная масса A, г/моль.
2. Oсмотическое давление водного раствора, в V мл которого содержится m г неэлектролита, при t °C равно pоcм. кПа. Найдите молекулярную массу неэлектролита и определите его истинную формулу, если простейшая формула – AxБyВz.
Решение.
T = t + 273,
где T – температура, К; t – температура,°C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
=
с∙R∙T,
откуда с![]() ,
,
где
c
– молярная концентрация A,
моль/л;
pоcм.
–
осмотическое давление раствора, кПа;
R
= 8,31
![]() –
универсальная газовая постоянная..
–
универсальная газовая постоянная..
с![]() ,
откуда
,
откуда
![]()
где n – количество вещества A, моль; 1000 мл/л – пересчетный коэффициент; V – объем раствора, мл; m – физическая масса A, г; M – молярная масса A, г/моль.
![]() ,
,
где M r – искомая молекулярная масса A, а.е.м.
ν
 ,
,
где
ν –
количественное соотношение между
истинной и простейшей формулами, единицы;
![]() – молекулярная
масса AxБyВz,
а.е.м. Истинная формула:
– молекулярная
масса AxБyВz,
а.е.м. Истинная формула:
Ax∙νБy∙νВz∙ν.
3. Найдите давление насыщенного пара растворителя В над ω%-ным раствором неэлектролита A при температуре кипения В. Давление насыщенного пара над чистой жидкостью при температуре кипения равно атмосферному.
Решение.
m1 = ω, m2 = 100 – ω,
где m1 и m2 – физические массы A и В в 100 г раствора, г; ω – массовая доля A, %.
![]() ,
,
где n1 и n2 – количества вещества A и В в 100 г раствора, моль; M1 и M2 – молярные массы A и В, г/моль.
![]() ,
,
где χ – мольная доля A, доли единицы.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
откуда
,
откуда
![]() ,
,
где p – искомое давление насыщенного пара над раствором, атм; p0 –давление насыщенного пара над чистым В, атм.
4. При какой температуре замерзает ω%-ный водный раствор неэлектролита A? Криоскопическая константа воды равна Кк K∙кг/моль.
Решение.
![]()
где m1 – физическая масса A в 100 г раствора, г; ω – массовая доля A, %.
![]()
где n – количество вещества A в 100 г раствора, моль; M – молярная масса A, г/моль.
![]() ,
,
где m – физическая масса воды в 100 г раствора, кг; 1000 г/кг – пересчетный коэффициент.
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам = Кк∙cm,
где Тзам – понижение температуры замерзания раствора относительно воды, К; Кк – криоскопическая константа воды, К·кг/моль.
tзам. р-ра = tзам. воды – Тзам,
где tзам. р-ра – искомая температура замерзания раствора, °C; tзам. воды – температура замерзания воды, °C.
ВАРИАНТ №7
1. Массовая доля А в растворе должна составлять ω %. Сколько г А и мл воды надо взять для приготовления m кг раствора?
Решение.
![]() ,
откуда m1
= 10∙ω∙m,
,
откуда m1
= 10∙ω∙m,
где ω – массовая доля А, %; m1 – искомая физическая масса А, г; m – физическая масса раствора, кг; 1000 г/кг – пересчетный коэффициент.
