
Решение задач на термодинамику и кинетику
.docПример задания (фрагмент ТАБЛИЦЫ ЗАДАНИЙ):
|
№ |
Уравнения реакций |
x1 |
x2 |
|
T1, K
|
T2, K
|
|
|
|
|
|
ОБЩИЙ ВИД |
ПРИМЕР |
|||||||||
|
пример |
a A + b B ⇄ c C + d D, |
2 H2О(г) + 2 Br2(г) ⇄ 4 HBr(г) + O2(г) |
2 |
0,5 |
2,4 |
278 |
303 |
3,5 |
2,5 |
1,5 |
где a, b, c, d - коэффициенты; A, B, C, D – формулы веществ с указанием агрегатного состояния.
1. Расчет
![]() (стандартной
энтальпии реакции при 298 К, кДж/моль):
(стандартной
энтальпии реакции при 298 К, кДж/моль):
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
где
|
= 4·(-36,38) + 0) – [2·(-241,81) + 2·30,91] = 276,28 кДж/моль. |
Определение типа реакции:
|
|
ОБЩИЙ ВИД |
ПРИМЕР |
||
|
= 0 |
> 0 |
< 0 |
|
|
|
Тип реакции |
атермическая |
эндотермическая |
экзотермическая |
эндотермическая. |
2. Формула для расчета Δn (изменения общего числа молекул газов в одном пробеге реакции):
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
Δn = c + d – (a + b) (коэффициенты перед формулами твердых веществ не учитываются) |
Δn = 4 + 1 – (2 + 2) = 1. |
Оценка
![]() (стандартной энтропии реакции при 298 K)
:
(стандартной энтропии реакции при 298 K)
:
|
Δn |
ОБЩИЙ ВИД |
ПРИМЕР |
||
|
= 0 |
> 0 |
< 0 |
Δn = 1 > 0 |
|
|
|
≈ 0 |
заметно > 0 |
заметно < 0 |
заметно > 0. |
Расчет
![]() :
:
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
где
|
– [2·188,72 + 2·245,37] = 131,18 Дж/(К·моль) = 0,13118 кДж/(К·моль) |
Сравнение качественной оценки с расчетным значением [«заметно», если порядок величины – это десятые кДж/(К·моль)]:
![]() = 0,13116 кДж/(К·моль)
> 0 и имеет порядок
десятых, т.
е. качественная оценка совпала с расчетным
значением.
= 0,13116 кДж/(К·моль)
> 0 и имеет порядок
десятых, т.
е. качественная оценка совпала с расчетным
значением.
Возможность самопроизвольного протекания реакции в изолированной системе при стандартных условиях и 298 К:
|
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
|
< 0 |
> 0 |
|
|
|
Реакция |
невозможна |
возможна |
невозможна |
3. Расчет
![]() (стандартной энергии Гиббса реакции
при 298 K,
кДж/моль):
(стандартной энергии Гиббса реакции
при 298 K,
кДж/моль):
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
|
|
Возможность самопроизвольного протекания реакции в закрытой системе при стандартных условиях и 298 К:
|
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
|
< 0 |
> 0 |
|
|
|
Реакция |
возможна |
невозможна |
невозможна. |
4. Выражение для Kс (константы равновесия, выраженной через равновесные концентрации […] веществ):
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
|
|
Расчет Kp (константы равновесия, выраженной через равновесные парциальные давления):
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
|
|
Оценка равновесного состава при стандартных условиях и 298 К [«близко к 1», если 0,001 ≤ Kp ≤ 1000]:
|
ОБЩИЙ ВИД |
ПРИМЕР |
|||
|
Kp |
<< 1 |
>> 1 |
близко к 1 |
Kp = 2,53·10-42 << 1 |
|
Равновесный состав |
преобладают реагенты |
преобладают продукты |
количества сопоставимы. |
преобладают продукты |
Для смещения равновесия реакции вправо:
|
ОБЩИЙ ВИД |
ПРИМЕР |
||||
|
|
= 0 |
> 0 |
< 0 |
|
|
|
Т надо |
не влияет |
повысить |
понизить |
повысить; |
|
|
Δn |
> 0 |
> 0 |
< 0 |
Δn = 1 > 0 |
|
|
общее давление p надо |
не влияет |
понизить |
повысить |
понизить |
|
|
газообразные |
реагенты надо добавить |
продукты надо отвести. |
H2О(г) и Br2(г) надо добавить, а HBr(г) и O2(г) надо отвести. |
||
5. Кинетическое уравнение (v – скорость; k – константа скорости; с(…) - текущие концентрации веществ) :
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
v
=
k{с(A)} |
v = k{с(H2О)}2{с(Br2)}0,5. |
Расчет числа раз, в которое увеличится скорость реакции:
|
ОБЩИЙ ВИД |
ПРИМЕР |
|
а)
( см. ТАБЛИЦУ ЗАДАНИЙ ); |
а)
|

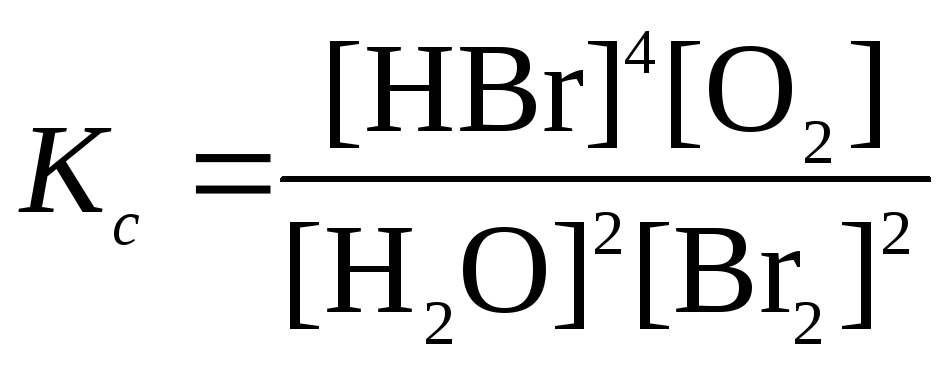
 ;
в)
;
в)
