
- •Тема 1. Кинематика поступательного и вращательного движения
- •Тема 2. Динамика поступательного движения. Элементы специальной теории
- •Тема 3. Динамика вращательного движения
- •Тема 4. Работа и энергия. Законы сохранения в механике
- •Тема 5. Распределение Максвелла и Больцмана
- •Тема 6. Средняя энергия молекул
- •Тема 7. Первое начало термодинамики. Работа при изопроцессах
- •Тема 8. Второе начало термодинамики. Энтропия
- •Тема 9. Электростатическое поле в вакууме
Тема 6. Средняя энергия молекул
Каждая молекула характеризуется числом степеней свободы (i) – это количество независимых движений, которые может совершать молекула:
одноатомная молекула может совершать три поступательных движения вдоль направлений координатных осей: i=3(пост);
двухатомная молекула с жесткими связями может совершать три поступательных и два вращательных движения: i=3(пост)+ 2 (вращ)=5;
трехатомная молекула и более может совершать три поступательных и три вращательных движения: i=3(пост)+ 3 (вращ)=6;
если связи между атомами внутри молекулы не жесткие, она совершает колебательные движения – добавляются колебательные степени свободы.
Полное число степеней свободы молекулы:
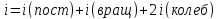 .
.
Например, молекула Н2 двухатомная с жесткими связями – число степеней свободы равно 5.
Закон
равнораспределения энергии по степеням
свободы молекулы:
на каждую поступательную и вращательную
степень свободы молекулы приходится
одинаковая порция энергии
 ,
а на каждую колебательную степень
свободы двойная порция энергии
,
а на каждую колебательную степень
свободы двойная порция энергии
 гдеk
– постоянная Больцмана, Т – температура
по шкале Кельвина.
гдеk
– постоянная Больцмана, Т – температура
по шкале Кельвина.
Тогда
полная
энергия молекулы,
равна:
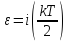 ,
,
где i – число степеней свободы молекулы.
Энергия
одного моля газа,
равна:
 ,
гдеR
– универсальная газовая постоянная.
,
гдеR
– универсальная газовая постоянная.
Энергия
произвольной массы газа,
равна: U .
.
Молярная
теплоёмкость газа при постоянном
объёме:  .
.
Молярная
теплоёмкость газа при постоянном
давлении:
 .
.
Пример 6.1. Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. При условии, что имеют место только поступательное и вращательное движение, средняя энергия молекул азота (N2) равна:
(7/2)kT (5/2)kT (3/2)kT (1/2)kT.
Решение
6.2. молекула азота двухатомная, число
степеней свободы равно 5, следовательно,
энергия молекулы равна
 .
.
Пример 6.3. При комнатной температуре отношение СP/СV при постоянном давлении и объеме равно 8/6 для:
гелия воздуха водяного пара кислорода
Решение: чтобы решить это задание нужно найти число степеней свободы молекулы с приведенным отношением теплоемкостей:
 ,
,
выведем
формулу для расчета i:
 ,
, ,
,
посчитаем  .
.
Число степеней свободы молекулы равно 6 – это трехатомная молекула, из вариантов ответов – это водяной пар Н2О.
Тема 7. Первое начало термодинамики. Работа при изопроцессах
первый закон термодинамики: в замкнутой макроскопической системе работа, произведенная над системой и количество теплоты, переданное системе, идут на изменение внутренней энергии системы:
 .
.
Применение первого закона термодинамики:
1)
изотермический процесс – все тепло,
поступающее в систему идет на совершение
работы:
 ,
, ,
, .
.
2) изохорный процесс – изменение внутренней энергии системы происходит за счет передачи тепла:
 ,
,
 ,
,
3)изобарный
процесс:  ,
, .
.
Из последнего выражения видно, что теплоемкость газа при изобарном процессе больше теплоемкости при изохорном процессе, что раньше мы записали в виде соотношения Майера.
Величины молярных теплоемкостей вещества могут быть рассчитаны, если известно число степеней свободы молекул вещества:







Отношение
теплоемкостей Ср
и
Сv
– постоянная
адиабаты:
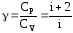 .
.
При
понижении температуры газа степени
свободы молекулы «замораживаются» и
ее теплоемкость уменьшается (см. рис.
Для кислорода).
адиабатный процесс – процесс происходит без теплообмена с окружающей средой:
 ,
, 
 ,
,
 ,
,
 ,
, .
.
5)циклические процессы – это круговые процессы: U=0, А= Q.
Пример 7.1. Идеальному газу сообщается одинаковое количество теплоты при изохорном (1), изобарном (2) и изотермическом (3) процессах. Для совершаемых газом работ справедливы соотношения:




Решение:
применение первого закона термодинамики
дает, что при изохорном процессе работа
равна нулю, при изобарном разности
полученного тепла и изменения внутренней
энергии, а при изотермическом – все
тепло пошло на совершение работы,
следовательно: 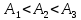 .
.
Пример
7.2. Диаграмма циклического процесса
идеального одноатомного газа представлена
на рисунке. Чему равно отношение работы
при нагревании газа к работе при
охлаждении?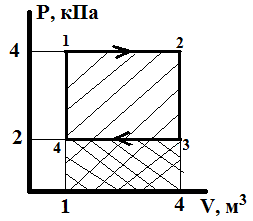
Решение:
работа совершается только при изменении
объема газа, т.е. на участках (1,2) и (3,4).
Это изобарные процессы, при которых
объем пропорционален температуре газа
(
 ),
следовательно участок (1,2) – нагревание,
а (3,4) – охлаждение.
),
следовательно участок (1,2) – нагревание,
а (3,4) – охлаждение.
Работа газа равна площади фигуры под графиком зависимости давления от объема. Работа при нагревании – площадь прямоугольника (141234):
Ан = 4(кПа) 4 (м3) =40004=16000 Дж.
Работа при охлаждении – площадь прямоугольника (1434):
Ао= 2(кПа) 4 (м3) =20004=8000 Дж.
Тогда отношение работ равно: Ан/Ао = 16000/8000 = 2. Ответ: 2.
Пример 7.3. Работа, совершаемая идеальным газом при его изобарном расширении, численно равна заштрихованной площади, показанной на рисунке …
Решение:
чтобы дать ответ необходимо определить
на каком графике изображен изобарный
процесс (при постоянном давлении) – на
рисунке 2. (Эти же рис. можно использовать
в задании о работе при изотермическом
процессе – ответ рис. 5., при круговом
процессе – ответ рис. 1.)
Пример 7.4. При изотермическом расширении 0,5 моля газа при температуре 200 К объем увеличился в е раз ( е=2,7). Чему равна работа газа (в Дж)?
Решение:
работа при изотермическом процессе
определяется по формуле:

где m/=0,5 моль; V2/V1=e; ln(е)=1; R=8,31Дж/мольК; T=200К
Ответ:

Пример 7.5. Одному молю двухатомного газа было передано 5155 Дж теплоты, при этом газ совершил работу, равную 1000 Дж. Насколько повысилась его температура? Ответ: на 200 K.
Решение: по условию задачи дано Q=5155 Дж; A’=1000Дж;
i = 5(число степеней свободы двухатомной молекулы); = 1 моль.
Первое начало термодинамики:
 ,
где
,
где  ,
,

Пример 7.6. Одноатомному идеальному газу в результате изобарического процесса подведено количество теплоты Q. На увеличение внутренней энергии газа расходуется часть теплоты U/Q, равная: 0,7 0,6 1,7 1,4
Решение: число степеней свободы молекул одноатомного газа равно трем (i=3). Запишем формулы для изобарного процесса:






Пример 7.7. Молярные теплоемкости гелия в процессах 1-2 и 1-3 равны С1 и С2 соответственно. Тогда С1 / С2 составляет…
3/5
7/5
5/7
5/3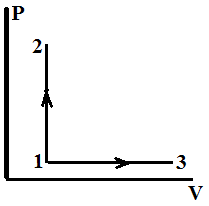
Решение: процесс 1-2 изохорный, а 1-3 изобарный.


Гелий одноатомный газ – число степеней свободы молекулы равно i=3, следовательно,



Пример 7.8. Состояние идеального газа определяется значениями параметров:T0, P0, V0, где Т – термодинамическая температура, Р – давление, V – объем газа. Определенное количество газа перевели из состояния (3Р0, V0) в состояние (Р0, 2V0). При этом его внутренняя энергия… увеличилась уменьшилась не изменилась
Решение: мерой внутренней энергии газа (и любого вещества) служит его температура. Если температура изменяется – так же изменяется внутренняя энергия, если температура неизменна – значит и внутренняя энергия не меняется. Т.о. чтобы решить это задание нам необходимо определить как меняеися температура газа.
Состояние газа характеризует уравнение Клапейрона-Менделеева:
 ,
следовательно, температура пропорциональна
произведению давления и объема (
,
следовательно, температура пропорциональна
произведению давления и объема ( ).
).
По
условиям задачи:  ,
,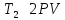 ,
следовательно
,
следовательно .
.
Пример 7.9. В цилиндре при сжатии постоянной массы воздуха давление возрастает в 3 раза. Если температура газа увеличилась в 2 раза, то отношение объемов до и после сжатия равно…
3/2 6 1/6 2/3
Решение: по условию задачи Р2 = 3Р1, Т2 = 2Т1. Определим объемы газа из уравнения Клапейрона-Менделеева:


 .
.
Пример 7.10. Если U – изменение внутренней энергии идеального газа, А – работа газа, Q – количество теплоты, сообщаемое газу, то для изохорного охлаждения газа справедливы соотношения…
Q 0; A 0; U = 0
Q = 0; A 0; U 0
Q 0; A = 0; U 0
Q = 0; A 0; U 0
Решение: изохорный процесс протекает при постоянном объеме, значит, работа равна нулю (А=0). При охлаждении температура и внутренняя энергия уменьшаются (U 0). Газ не совершает работу, охлаждается, значит, он отдает тепло (Q 0).
(если бы происходило адиабатное сжатие газа – тепло не поступает Q = 0; сжатие A 0; при сжатии газ нагревается U 0 – ответ вторая строчка). Самостоятельно рассмотрите адиабатическое расширение, изотермическое сжатие, изобарное охлаждение, изобарное нагревание.
