
Лабораторная работа Т-2
Определение отношения удельных
теплоёмкостей γ=Ср/Сv газов методом
адиабатического расширения (метод Клемана-Дезорма).
Приборы и принадлежности: стенд, состоящий из герметического баллона с краном, насоса для закачки газа, манометра и соединительных трубок (рисунок 2).
1. Теоретическая часть
Основные термодинамические понятия, состояния и определения.
1.1 Первое начало термодинамики
Рассмотрим формы превращения энергии для частного случая термодинамической системы (рис.1). Подвижный поршень В может двигаться в цилиндре Ас газомЕ. Площадь поршняS, перемещениеdl. Газ находится под давлениемР, он может нагреваться нагревателемСили охлаждаться холодильникомД.
В двигая
поршень в цилиндр и совершая работу, мы
сжимаем газ, в результате чего температура
газа повышается и увеличивается его
внутренняя энергия. С другой стороны,
температуру газа можно повысить иначе
– нагреванием, за счет передачи тепла
извне от нагревателя С. Мы видим, что в
этой системе возможны две формы передачи
энергии от одних тел к другим – в форме
работы (макроскопические перемещения
тел системы под действием сил) и в форме
теплоты (части энергии хаотического
движения молекул и излучения). Энергия
макроскопического механического
перемещения может превращаться в энергию
теплового движения молекул и наоборот.
При этих превращениях соблюдается
всеобщий закон сохранения и превращения
энергии. Его формулировка для процессов
теплообмена, теплопередачи и перехода
тепла в другие формы энергии называетсяпервым началом
термодинамики.
двигая
поршень в цилиндр и совершая работу, мы
сжимаем газ, в результате чего температура
газа повышается и увеличивается его
внутренняя энергия. С другой стороны,
температуру газа можно повысить иначе
– нагреванием, за счет передачи тепла
извне от нагревателя С. Мы видим, что в
этой системе возможны две формы передачи
энергии от одних тел к другим – в форме
работы (макроскопические перемещения
тел системы под действием сил) и в форме
теплоты (части энергии хаотического
движения молекул и излучения). Энергия
макроскопического механического
перемещения может превращаться в энергию
теплового движения молекул и наоборот.
При этих превращениях соблюдается
всеобщий закон сохранения и превращения
энергии. Его формулировка для процессов
теплообмена, теплопередачи и перехода
тепла в другие формы энергии называетсяпервым началом
термодинамики.
Теплота, сообщаемая системе, расходуется на увеличение её внутренней энергии и на совершение ею работы против внешних сил
Q=ΔU+A, (1) где Q- кол-во теплоты, полученное системой;
ΔU- изменение её внутреннеё энергии;
А – работа, совершенная системой против внешних сил.
Для бесконечно малого изменения состояния системы (1) будет иметь вид
dQ=dU+dA, (2)
где dQ, dU, dA – бесконечно малые изменения тепла внутренней энергии и работы против внешних сил соответственно.
Теперь введем некоторые понятия и определения, которые будут использоваться в дальнейшем.
1.2 Полная работа системы
Работа термодинамической системы (рис.1) против внешних сил в общем виде имеет вид
dA=p.dV, (2)
где dV- бесконечно малое перемещение;
p- давление газа Е.
Полная работа А, совершаемая газом при изменении его объёма от V1 до V2, определится интегралом
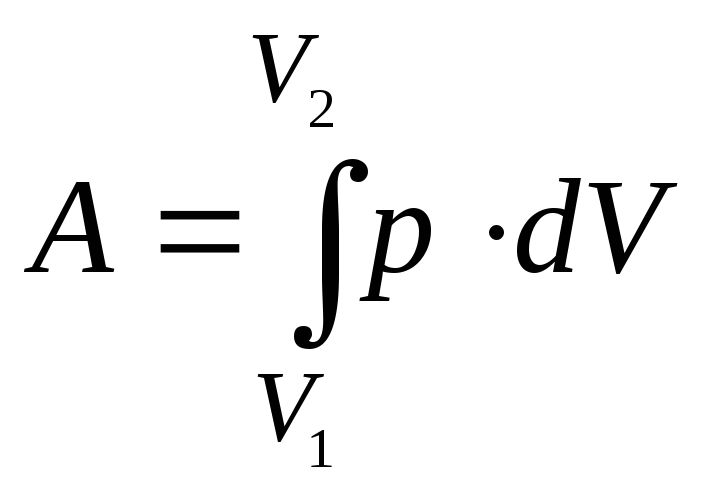 ,
(3)
,
(3)
Для интегрирования нужно знать зависимость pот объёма.
1.3 Удельная теплоёмкость
Удельной теплоёмкостью вещества С называется величина, равная количеству теплоты, необходимому для нагревания единицы массы вещества (1 кг в системе СИ) на 1К
![]() ,
(4)
,
(4)
