
- •Основные теоретические сведения
- •Предельные углеводороды
- •1.1. Общие сведения, номенклатура предельных углеводородов
- •1.2. Химические свойства
- •Этиленовые углеводороды
- •Общие сведения, номенклатура этиленовых углеводородов
- •2.2. Химические свойства алкенов
- •Реакции окисления
- •Ацетиленовые углеводороды
- •Общие сведения, номенклатура ацетиленовых углеводородов
- •Химические свойства ацетиленовых углеводородов
- •Реакции присоединения
- •Реакции замещения
- •Реакции полимеризации
- •Реакции конденсации с карбонильными соединениями
- •Экспериментальная часть
- •Контрольные вопросы
- •Список рекомендуемой литературы
Реакции полимеризации
В зависимости от условий реакции и катализаторов могут образовываться разные продукты реакции.
1) Образование бензола, происходит в присутствии катализатора – активированного угля.

![]()
ацетилен бензол
2) Образование винилацетилена, катализатор Cu2Cl2
![]()
ацетилен винилацетилен
При присоединении к винилацетилену хлороводорода образуется хлоропрен.

винилацетилен хлоропрен
3) Образование
циклооктатетраена (катализаторы -
соединения Ni
при p![]() около
2 МПА)
около
2 МПА)



ацетилен циклооктатетраен
Реакции конденсации с карбонильными соединениями
Это реакции, имеющие большое практическое значение. Например, из ацетилена и ацетона можно получить изопрен (реакция Фаворского).

ацетон ацетилен
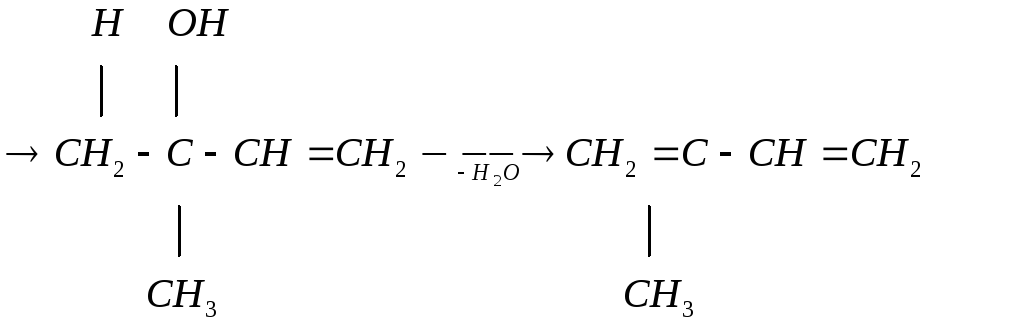
изопрен
Реакции окисления
Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор обесцвечивается. Эта реакция на двойную, а также и тройную связь. При окислении происходит расщепление тройной связи с образованием карбоновых кислот.
![]()
диметилацетилен уксусная кислота
ЛАБОРАТОРНАЯ РАБОТА
«ПРЕДЕЛЬНЫЕ, ЭТИЛЕНОВЫЕ И АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ»
Правила по технике безопасности
1. Органические вещества и продукты их реакций могут быть токсичны или взрывоопасны. Поэтому четко следуйте методическим указаниям при выполнении лабораторной работы.
2. Метан, этилен, ацетилен получайте в вытяжном шкафу.
3. При получении метана и этилена помните, что выделяющийся газ пропускают через раствор бромной воды и KMnO4, не прекращая нагревания пробирки в которой идет реакция получения метана и этилена. В случае прекращения нагревания жидкость из пробирок с KMnO4 и Br2 может по газоотводной трубке попасть в пробирку с нагретой смесью и вызвать разрушение этой пробирки.
4. Полученный в опыте 4 ацетиленид меди в пробирке следует отдать лаборанту для утилизации.
Экспериментальная часть
Опыт № 1 Получение метана и исследование его свойств
В сухую пробирку поместите 5 граммов тщательно растертой в ступке смеси: на 1 часть безводного ацетата (СH3COOK, CH3COONa, (CH3COO) 2Ca) 2 части натронной извести (натронная известь - смесь NaOH и CaO). Пробирку закройте пробкой с газоотводной трубкой и закрепите в штативе. Смесь медленно и равномерно нагрейте.
Не прекращая нагревания, опустите конец газоотводной трубки в бромную воду и подкисленный раствор KMnO4 .Изменилась ли окраска растворов? Поджигаем метан, выходящий из газоотводной трубки, наблюдайте за окраской пламени.
Опыт № 2 Получение и исследование свойства этилена
В пробирку помещают 1 мл спирта и 4 мл концентрированной H2SO4, бросают кипятильный камешек и медленно и осторожно нагревают до начала равномерного выделения газа. Выделяющийся газ пропускают через разбавленный раствор подкисленного KMnO4 и светло желтый раствор бромной воды. Изменилась ли окраска растворов? Подожгите этилен и наблюдайте окраску пламени.
Опыт № 3 Образование и исследование свойств ацетилена
В пробирку с газоотводной трубкой и отверстием внизу помещаем стекловату, на нее кладем кусочки карбида кальция. Сверху также помещаем стекловату. Газоотводная трубка имеет винтовой зажим. Внизу пробирки находится стакан с водой, вода в стакане должна быть выше уровня карбида кальция в пробирке. При открывании зажима вода поднимается в пробирку через нижнее отверстие. Образовавшийся ацетилен выделяется через газоотводную трубку. При закрывании зажима реакция в пробирке прекращается. Наблюдаем бромирование и окисление ацетилена перманганатом калия. Изменилась ли окраска раствора?
При горении ацетилена наблюдаем окраску пламени. Чтобы ацетилен выделялся более спокойно вместо воды используют насыщенный раствор NaCl.
Опыт № 4 Получение ацетиленида меди
В пробирку поместите 1 мл аммиачного раствора CuCl и пропустите ток ацетилена. Наблюдайте выпадение осадка, запишите его цвет.
