
- •Эквивалент вещества
- •Теоретическая часть.
- •1.Эквивалент вещества. Эквивалентное число.
- •2. Расчет z(в) в окислительно-восстановительных реакциях.
- •3. Расчет z(в) в обменных реакциях.
- •4. Молярная масса и молярный объем эквивалентов вещества.
- •5. Количество вещества эквивалентов.
- •6. Закон эквивалентов.
- •7. Закон эквивалентов для реакций, протекающих в растворах.
- •Лабораторная работа №1 Определение молярной массы эквивалентов простого вещества.
- •Последовательность выполнения эксперимента.
- •Расчет экспериментального значения молярной массы эквивалентов алюминия и ошибки эксперимента.
- •Вопросы к защите лабораторной работы №1.
- •Лабораторная работа №2. Определение молярной массы сложного вещества.
- •Результаты опыта 1 записать в следующей форме:
- •Расчет Сэк(NaOh)
- •Результаты опыта 2 записать в следующей форме:
- •Расчет Mэк неизвестной кислоты
- •Вопросы к защите лабораторной работы №2.
7. Закон эквивалентов для реакций, протекающих в растворах.
Молярная концентрация эквивалентов.
При проведении реакции в растворе содержание растворенного вещества можно рассчитать, зная объем раствора и молярную концентрацию эквивалентов растворенного вещества. Молярная концентрация эквивалентов равна количеству вещества эквивалентов растворенного вещества, содержащемуся в одном литре раствора. Обозначение сэк(В). Единицы измерения моль-эк/л.
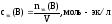 (32)
(32)
где nэк(В) – количество вещества эквивалентов растворенного
вещества, моль-эк;
V – объем раствора, л.
Запись сэк(Na2SO4) = 0,1 моль-эк/л следует понимать так: в 1 литре раствора содержится 0,1 моль-эк Na2SO4 .
Единицы измерения моль-эк/л можно заменить буквой "н".
сэк(H3PO4) = 0,2 моль-эк/л. или сэк(H3PO4) = 0,2 н.
Из уравнения (32) следует, что nэк растворенного вещества в растворе, объем которого равен V, равно:
nэк(В) = сэк(В) · V (33)
Тогда для реакции (26), записанной в общем виде и протекающей в растворе, закон эквивалентов для реагентов будет записываться в следующем виде:
сэк(А) · V(A) = сэк(B) · V(B), (34)
где сэк(А), сэк(B) – молярные концентрации эквивалентов растворов, моль-эк/л;
V(A), V(B) – объемы растворов А и В, л или см3.
Пример. На нейтрализацию 20 см3 раствора H2SO4 израсходовано 25 см3 раствора KOH, молярная концентрация эквивалентов которого равна 0,1 н. Рассчитать молярную концентрацию эквивалентов раствора кислоты.
Решение. Согласно закону эквивалентов:
nэк(H2SO4) = nэк(KOH).
nэк можно выразить через сэк(B) и объем раствора (см. уравн. 33):
сэк(H2SO4) · V(H2SO4) = сэк(KOH) · V(KOH)
Отсюда
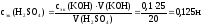
При решении задач по закону эквивалентов следует помнить:
1. Молярная масса эквивалентов сложного вещества может быть рассчитана по правилу сложения (аддитивности), т.е. равна сумме молярных масс эквивалентов структурных элементов, образующих данное вещество.
а) oксиды ЭnОm, где Э - элемент; О – кислород.
Мэк(ЭnОm) = Мэк(Э) + Мэк(О2) Мэк(О2) = 8 г/моль (35)
б) кислоты НnХ, где Н – водород; Х – кислотный остаток.
Мэк(НnХ) = Мэк(Н2) + Мэк(Х) Мэк(Н2) = 1 г/моль (36)
в) основания Ме(ОН)n, где Ме – металл, ОН – гидроксильная группа
Мэк(Ме(ОН)n) = Мэк(Ме) + Мэк(ОН) Мэк(ОН) = 17 г/моль (37)
г) соли МеnXm, где Ме – металл; Х – кислотный остаток
Мэк(МеnXm) = Мэк(Ме) + Мэк(Х) (38)
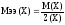 (38а)
(38а)
Эквивалентное число кислотного остатка Х по величине равно его заряду.
д) гидриды МеНn, где Ме – металл; Н – водород
Мэк(МеНn) = Мэк(Ме) + Мэк(Н2) Мэк(Н2) = 1 г/моль (39)
2. Молярная масса эквивалентов элемента связана с абсолютной величиной степени окисления этого элемента в соединении соотношением:
![]()
![]() ,
(40)
,
(40)
где М(Э) – молярная масса элемента, г/моль;
|С.О.(Э)| – степень окисления элемента по модулю.
3. Можно пользоваться схемой химического процесса, т.е. указывать только реагенты и продукты, не расставляя уравнивающие стехиометрические коэффициенты.
Например:
Ме + О2 →МеnОm (41)
Ме + кислота → Н2 + соль (42)
кислота + основание → соль + вода (43)
Пример. При окислении 10,8 г металла образовалось 20,4 г оксида металла. Вычислите Мэк(Ме) и Мэк(МеnОm).
Решение. Запишем схему процесса:
Ме + О2 → МеnОm
и закон сохранения массы:
m(O2) + m(Me) = m(МеnОm)
Отсюда m(O2) = 20,4 – 10,8 =9,6 г
Согласно закону эквивалентов:
![]() ,
,
учитывая, что Мэк(О2) = 8 г/моль-эк (см. табл. 4), находим:
![]()
Поскольку для оксидов Мэк(ЭnОm) = Мэк(Э) + Мэк(О2), то получаем
Мэк(MenOm) = 9 + 8 = 17 г/моль-эк.
Пример. Рассчитать молярную массу эквивалентов и молярную массу металла, если в гидриде этого металла на 1 атом металла приходится 2 атома водорода, а массовая доля водорода в гидриде составляет 4,76 %.
Решение. Гидрид представляет собой соединение металла с водородом. Составим схему образования гидрида:
Ме + H2 → Ме H2
Запишем закон эквивалентов:
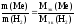
Чтобы рассчитать Мэк(Ме) необходимо знать m(Me) и m(H2), а Мэк(Н2) = 1 г/моль-эк (см.табл. 4).
Поскольку ω%(Ме) + ω%(Н2) = 100%,
то w %(Me) = 100 – 4,74 = 95,24 %.
Если принять массу гидрида равной 100 г , то массы составляющих его элементов численно будут равны их массовым долям в соединении. Чтобы убедиться в этом, составим и решим пропорции относительно m(Me) и m(H2):
m(MeH2) – 100%
m(Me) – w %(Me)
![]()
m(MeH2) – 100%
m(H2) – w %( H2),
![]()
Подставляя в закон эквивалентов соответствующие значения, получаем:
![]()
Т.к. Мэк(Ме) и М(Ме) связана соотношением
![]()
то
![]()
С.О.(Ме) = +2 поскольку из условия задачи известно, что на 1 атом металла приходится 2 атома водорода, а степень окисления водорода в гидридах равна –1. Рассчитываем молярную массу металла:
М(Ме) = 20·2 = 40 г/моль.
ЗАДАЧИ
1.Вычислите: а) Vэк(N2O5);
б) Мэк(В): Ni2O3,MnSO4,HCN;
в) Мэк(Со(ОН)2) в реакции
2Co(OH)2 + H2SO4 = (CoOH)2SO4 + 2H2O.
2.В какой массе H2SO4 содержится столько же nэк (H2SO4), сколько в 140 г Cr(OH)3?
3. Определите степень окисления железа в сульфиде (FexSy), содержащим 53,85 % железа. C.O.(S) = –2.
4..Молярная масса эквивалентов некоторого металла равна
9,0 г/моль-эк. Определите объем кислорода (н.у.), необходимый для окисления 15,2 г этого металла. Рассчитайте массовую долю этого металла в его оксиде.
5.Оксид пятивалентного элемента содержит 43,67 % элемента. Определите атомную массу и назовите элемент.
