
- •Федеральное агентство по образованию
- •Введение
- •Тема 1 атомный уровень организации вещества
- •Атом это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра.
- •Модели атомов
- •Итак, атом это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра.
- •1.2. Взаимодействия в атомах
- •1.3. Свойства атомов
- •1.4. Периодический закон д.И. Менделеева. Квантовые законы
- •18 Элементов
- •Краткий итог темы
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 2 молекулярный уровень организации вещества. Кристаллы с ионной и металлической связью
- •2.1. Модели молекул. Ковалентная химическая
- •2.2. Гибридизация, - и -связи
- •2.3. Донорно-акцепторная связь
- •2.4. Ионная связь
- •Электроотрицательность атомов, по Полингу
- •2.5. Металлическая связь
- •2.6. Квантовые правила образования химических
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 3 твердые вещества, жидкости и газы
- •3.1. Модели кристаллических и аморфных веществ
- •Аморфные тела
- •Жидкие кристаллы
- •3.2. Жидкости и газы
- •Решение
- •3.3. Взаимодействия в макросистемах
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 4 термодинамические свойства макросистем законы термодинамики
- •4.1. Закон термического равновесия
- •4.2. Первый закон термодинамики
- •Решение
- •4.3. Свойства термодинамической системы
- •Решение
- •4.4. Применение первого закона термодинамики
- •Энергии связей некоторых двух- и трехатомных молекул
- •Решение
- •Решение
- •4.5. Второй закон термодинамики
- •Стандартные энтальпии образования и абсолютные энтропии некоторых веществ
- •4.6. Термодинамический взгляд на химическое равновесие. Химический потенциал индивидуального соединения
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 5 скорость и механизм химических реакций
- •5.1. Кинетика химических процессов
- •Простые реакции
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Энтальпии образования и абсолютные значения энтропии некоторых простых и сложных веществ
- •Список рекомендуемой литературы Основная
- •Дополнительная
- •Содержание
- •Тема 5. Скорость и механизм химической реакции………………….115
Решение
N2(г) + О2(г) = 2NO(г), Н =?
Eсв +945,3 +498,4 2 (–632)
Используются данные, приведенные в табл.3.
Н1 = [945,3 + 498.4] + 2 [–632] = 179.7 кДж.
При окислении 84 г N2 (3 моль азота):
Н2 = 3179.7 = 539.1 кДж.
Окисление 84 г азота в избытке кислорода сопровождается поглощением из окружающей среды 539,1 кДж энергии. Реакция эндотермическая.
Приведенные в примерах расчеты Н по энергиям химических связей имеют ограниченное применение и используются в основном для двух- и трехатомных молекул.
В
термохимии основными данными для
проведения термохимических расчетов
служат энтальпии образования сложных
соединений из простых веществ
![]() (f
– formation).
Энтальпия
образования
(f
– formation).
Энтальпия
образования
![]() сложного
вещества есть энтальпия реакции синтеза
его из простых веществ, взятых в наиболее
устойчивых физических состояниях при
заданном внешнем давлении р = 1 атм и
температуре Т.
сложного
вещества есть энтальпия реакции синтеза
его из простых веществ, взятых в наиболее
устойчивых физических состояниях при
заданном внешнем давлении р = 1 атм и
температуре Т.
Под простыми веществами подразумеваются все химические элементы периодической системы в кристаллической форме, характерной для металлов (за исключением ртути), и молекулярной форме для неметаллов (за исключением благородных газов) в том агрегатном состоянии, которое для них характерно при внешнем давлении 1 атм.
Для
внешнего давления, равного 1 атм и
температуре T
= 298.15 К, в справочных таблицах
термодинамических величин (см. приложение)
даются стандартные энтальпии образования
соединений
разной
степени сложности. Например, энтальпия
образования
![]() СО2(г)
=
393.51 кДж/моль относится к реакции
СО2(г)
=
393.51 кДж/моль относится к реакции
С(графит) + О2(г) = СО2(г);
С(графит) и О2(газ) – простые вещества.
Энтальпия образования всех простых веществ принята за начало отсчета и равна нулю.
Задачей
термохимии является расчет энтальпий
химических реакций
![]() по
табличным значениям
по
табличным значениям
![]() ,
опираясь на закон Гесса.
,
опираясь на закон Гесса.
Основной закон термохимии (закон Гесса, 1836 г.) в современной интерпретации утверждает, что энтальпия реакций, протекающих либо при V,T = const, либо p,T = const не зависти от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. Например, экспериментально невозможно определить значение H1 реакции:
С(гр)
+
![]() О2(г)
СО(г); H1
= ?
О2(г)
СО(г); H1
= ?
так как при сжигании графита, как правило, образуется смесь оксидов (СО2 и СО).
В соответствии с законом Гесса можно преодолеть это затруднение, измерив экспериментально (в калориметре) энтальпии следующих реакций:
С(гр) + О2(г) СО2(г); H2 = 393,51 кДж/моль,
СО(г)
+
![]() О2(г)
СО2(г);
H3
=
282,99 кДж/моль.
О2(г)
СО2(г);
H3
=
282,99 кДж/моль.
Представим возможные пути превращений исходных соединений.
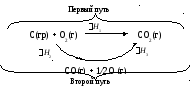
Поскольку H есть функция состояния системы, в которой происходят реакции, то в соответствии с законом Гесса независимо от того, идет реакция по первому или второму пути:
H1 = H2 + H3 или
H2 = H1 H3 = ( 393,51) ( 282,99 ) = 110, 52 кДж.
Именно столько энергии выделяется (экзотермический процесс) при образовании 1 моль СО из С(гр) и 1/2О2(г). Эта величина вычислена теоретически.
В
соответствии с законом Гесса с
термохимическими уравнениями можно
обращаться как с алгебраическими. Их
можно складывать друг с другом или
вычитать из одного уравнения другое.
Именно эти операции используют при
вычислении энтальпии реакции
![]() (r
– reaction),
используя табличные данные энтальпий
образования
(r
– reaction),
используя табличные данные энтальпий
образования
![]() участников термохимической реакции.
участников термохимической реакции.
Воспользуемся табличными данными термохимических величин, приведенных в приложении, для вычисления энтальпии реакции разложения карбоната кальция:
СаСО3(т)
СаО(т) + СО2(г);
![]() =
?
=
?
![]() кДж/моль:
1206
635.1
393.51
кДж/моль:
1206
635.1
393.51
Для
того чтобы вычислить
![]() указанной реакции, необходимо из суммы
энтальпий образования продуктов реакции
вычесть сумму энтальпий образования
исходного вещества:
указанной реакции, необходимо из суммы
энтальпий образования продуктов реакции
вычесть сумму энтальпий образования
исходного вещества:
![]() =
[
=
[![]() прод.]
[
прод.]
[![]() исх.],
исх.],
![]() =
[(
635.1) + (
393.51)]
[
1206] = 177.39 кДж.
=
[(
635.1) + (
393.51)]
[
1206] = 177.39 кДж.
В том, что именно такую алгебраическую операцию нужно совершить, можно убедиться, если записать реакции образования участников процесса:
Са(т)
+ 1/2О2(г)
СаО(т);![]() (СаО)
=
635.1 кДж,
(СаО)
=
635.1 кДж,
С(т)
+ О2(г)
СО2(г);
![]() (СО2)
=
393.51 кДж,
(СО2)
=
393.51 кДж,
С(т)+3/2О2(г)+С(т)СаСО3(т);
![]() (СаСО3)
=
1206 кДж.
(СаСО3)
=
1206 кДж.
При вычитании из алгебраической суммы первых двух уравнений третьего и выполнении необходимых сокращений и переносов получим:
СаСО3(т) СаО(т) + СО2(г); [( 635.1) + ( 393.51)] [ 1206],
СаСО3(т) СаО(т) + СО2(г); rН0(298) = 177.39 кДж.
