
- •И.А. Зеляев, о.М. Захарова, с.В. Митрофанова химия Лабораторные работы
- •Содержание
- •Введение
- •Форма титульного листа лабораторного журнала для оформления
- •Лабораторная работа № 2 «Химическое равновесие»
- •Лабораторная работа № 3 «Скорость химических реакций»
- •Лабораторная работа № 4 «Приготовление раствора соды заданной концентрации»
- •Лабораторная работа № 5 «Измерение водородного показателя некоторых растворов»
- •Лабораторная работа № 6 «Исследование скорости коррозии цинка в соляной кислоте»
- •Лабораторная работа № 7 «Распознавание строительных материалов»
Лабораторная работа № 6 «Исследование скорости коррозии цинка в соляной кислоте»
Цель работы
Определить скорость коррозии в соляной кислоте чистого цинка и цинка в составе гальванической пары цинк-медь.
Теоретическая часть
При взаимодействии цинка с соляной кислотой окислительно-восстановительная реакция протекает по схеме:
![]()
![]() - окисление (анодный
процесс).
- окисление (анодный
процесс).
![]() - восстановление
(катодный процесс).
- восстановление
(катодный процесс).
В случае чистого цинка оба эти процесса протекают одновременно в каждой точке на поверхности металла и в значительной степени «мешают» друг другу. При контакте цинка с менее активным металлом (например, Cu, Au, Ag и т.д.) происходит образование коррозионного гальванического элемента. Анодный окислительный процесс протекает на поверхности цинка, а катодное восстановление ионов водорода – на поверхности второго металла. Разделение анодного и катодного процесса значительно увеличивает общую скорость реакции.
Экспериментальная часть
О скорости растворения (коррозии) цинка в соляной кислоте удобно судить по количеству водорода, выделяющегося в единицу времени.

4
3
2 5
1
Рис. Схема установки для исследования коррозии металлов
1 – реакционный сосуд; 2 – пробка с резиновым шлангом; 3 – мерная бюретка; 4 – кран для подъема воды в бюретку; 5 – емкость с водой
Ход работы:
Опыт 1
В малое колено реакционного сосуда поместить кусочек чистого металлического цинка.
В большое колено с помощью мерного цилиндра осторожно по стенке влить 25 мл 15% раствора HCl.
Удерживая реакционный сосуд горизонтально, закрыть его пробкой (2).
Надеть на носик крана (4) резиновую грушу в сжатом виде и поднять уровень воды в бюретке к нулевому делению шкалы.
Наклонить реакционный сосуд и сбросить кусочек цинка в кислоту. Наблюдать начало реакции; при проскоке первого пузырька водорода в бюретку включить секундомер.
В течение 3 минут через каждые 30 секунд отмечать уровень воды в бюретке; данные занести в таблицу.
Вынуть резиновую пробку (2), промыть реакционный сосуд водой.
Опыт 2
Взять кусочек цинка, предварительно обмотанный медной проволокой и проделать операции 1 – 7 , как описано в опыте 1, результаты также занести в таблицу.
Например, получены данные:
Таблица
Зависимость объема выделившегося водорода от времени
|
опыт |
τ, мин |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
|
1 |
|
3,5 |
8 |
12,8 |
17,5 |
22,0 |
- |
|
2 |
|
5 |
12 |
16 |
21,5 |
- |
- |
По данным опытов 1 и 2 построить график зависимости объема выделившегося водорода от времени.
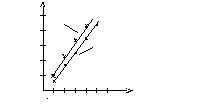
![]()
25 опыт 2
20
15 опыт 1
10
5
![]() ,
мин
,
мин
0 1 2 3
Рис. График зависимости объема выделившегося
водорода от времени
Из графика вычислить
среднюю скорость выделения водорода
как отношение
![]() мл/мин
мл/мин
Например:
![]() мл/мин
мл/мин
![]() мл/мин
мл/мин
Пересчитать по уравнению химической реакции скорость выделения водорода на скорость растворения цинка в размерности г/мин.
![]()
1 моль 1 моль
 65 г - - - - - -
- - 22 400 мл
65 г - - - - - -
- - 22 400 мл
х1
г - - - - - - - - - - - 9 мл
![]() г/мин
г/мин
х2
г - - - - - - - - - - 12 мл
![]() г/мин
г/мин
Выводы:
Исследована скорость коррозии цинка в соляной кислоте.
Показано, что в случае чистого цинка скорость коррозии составляет 0.027 г/мин.
В составе гальванической пары Zn-Cu скорость коррозии возрастает до 0,032 г/моль, т.е. примерно в 1,2 раза.
