
- •И.А. Зеляев, о.М. Захарова, с.В. Митрофанова химия Лабораторные работы
- •Содержание
- •Введение
- •Форма титульного листа лабораторного журнала для оформления
- •Лабораторная работа № 2 «Химическое равновесие»
- •Лабораторная работа № 3 «Скорость химических реакций»
- •Лабораторная работа № 4 «Приготовление раствора соды заданной концентрации»
- •Лабораторная работа № 5 «Измерение водородного показателя некоторых растворов»
- •Лабораторная работа № 6 «Исследование скорости коррозии цинка в соляной кислоте»
- •Лабораторная работа № 7 «Распознавание строительных материалов»
Лабораторная работа № 2 «Химическое равновесие»
Цель работы
Определить направление смещения химического равновесия для реакций, протекающих в жидкой и газообразной фазе.
Теоретическая часть
В природе лишь
ограниченное число процессов (химических
реакций) протекает необратимо. В
зависимости от условий многие химические
реакции могут протекать как в прямом,
так и в обратном направлении. Это
означает, что исходные вещества не могут
на 100% превратиться в продукты реакции,
так как последние взаимодействуют между
собой с образованием тех же исходных
веществ. Такие реакции, называемые
обратимыми, заканчиваются установлением
химического равновесия, когда в системе
присутствуют в той или иной концентрации
все участники реакции. В состоянии
равновесия в системе скорости прямой
и обратной реакции равны, не происходит
изменения концентраций реагентов и
термодинамических функций состояния
системы
![]() .
.
Соотношение концентраций в равновесной системе характеризуется величиной, называемой константой равновесия.
Например, для гомогенной реакции синтеза аммиака

![]()
![]() кДж
(1)
кДж
(1)
константа равновесия запишется:
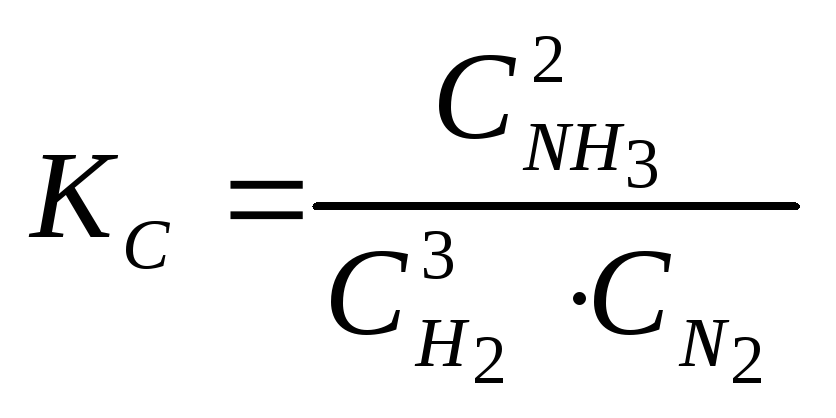 ;
;
Константа равновесия для каждой химической реакции имеет свое численное значение, которое не зависит от абсолютного значения концентраций, давления газообразных веществ или наличия в системе катализаторов. Однако К существенным образом зависит от температуры
![]()
Химическое равновесие, установившееся при определенных условиях (Р, Т, С), может поддерживаться как угодно долго, если условия не изменяются. При изменении условий (одного или сразу нескольких) равновесие смещается в сторону либо прямой, либо обратной реакции и устанавливается новое состояние равновесия.
Направление смещения равновесия определяется на основании принципа Ле-Шателье: «Если на равновесную систему оказать внешнее воздействие (изменить Р, Т, С), то равновесие сместится в сторону той реакции (прямой или обратной), которая частично компенсирует внешнее воздействие».
Например, для
реакции (1) увеличение
![]() приводит к смещению равновесия в сторону
прямой реакции, увеличение
приводит к смещению равновесия в сторону
прямой реакции, увеличение![]() - в сторону обратной реакции. Нагревание
равновесной смеси приводит к частичному
разложению аммиака, то есть равновесие
смещается в сторону обратной реакции,
которая является эндотермической.
Повышение общего давления в данной
системе должно частично компенсироваться
протеканием процесса, идущего с
уменьшением числа молей газов, то есть
равновесие смещается в сторону прямой
реакции.
- в сторону обратной реакции. Нагревание
равновесной смеси приводит к частичному
разложению аммиака, то есть равновесие
смещается в сторону обратной реакции,
которая является эндотермической.
Повышение общего давления в данной
системе должно частично компенсироваться
протеканием процесса, идущего с
уменьшением числа молей газов, то есть
равновесие смещается в сторону прямой
реакции.
Экспериментальная часть
Опыт 1. Обменная реакция между раствором хлорного железа и раствором роданида аммония сопровождается изменением окраски раствора.

![]()
![]()
(р-р) (р-р) (р-р) (р-р)
слабожелтый бесцветный интенсивно- бесцветный
- красный
При этом в реакционном сосуде устанавливается химическое равновесие, для которого константа равновесия имеет вид:

Ход работы:
В пробирку налить по 5мл 0,02 М растворов хлорного железа и роданида аммония, интенсивно встряхнуть. Раствор окрасится в темно-красный цвет.
Полученный раствор разлить в 4 пробирки. Первую пробирку оставить как эталон окраски.
Во вторую добавить 3-4 капли насыщенного раствора
 ;
в третью – 3-4 капли насыщенного раствора
;
в третью – 3-4 капли насыщенного раствора ;
в четвертую – несколько кристаллов
;
в четвертую – несколько кристаллов .
.Результаты наблюдения занести в таблицу и сделать вывод о направлении смещения равновесия.
Раствор в 1-ой (эталонной) пробирке разбавить дистиллированной водой и сделать вывод о смещении равновесия в этом случае.
Таблица 1
Направление смещения равновесия
|
№ пробирки |
Что добавлено |
Изменения интенсивности окраски |
Направление смещения равновесия |
|
1 |
|
уменьшение |
нет смещения |
|
2 |
|
увеличение |
|
|
3 |
|
увеличение |
|
|
4 |
|
уменьшение |
|
Опыт 2. Смещение химического равновесия для реакций, протекающих в газовой среде.
Обратимая химическая реакция димеризации оксида азота в газовой фазе сопровождается значительным изменением окраски

![]()
![]()
бурый бесцветный
Константа равновесия данной реакции имеет вид

Так как данная реакция имеет довольно существенный тепловой эффект, то изменение температуры приводит к заметному изменению цвета газовой смеси.
Ход работы:
Взять стеклянный прибор (см. рис.), заполненный смесью
 и
и ,
находящихся в состоянии химического
равновесия при комнатной температуре.
Отметить одинаковую интенсивность
окраски в обеих частях прибора.
,
находящихся в состоянии химического
равновесия при комнатной температуре.
Отметить одинаковую интенсивность
окраски в обеих частях прибора.Поставить рядом два химических стакана: один – с горячей, а другой – с холодной водой.
Одновременно опустить прибор в оба стакана, наблюдать изменение окраски при охлаждении и нагревании смеси
 и
и .
Занести опытные данные в таблицу.
.
Занести опытные данные в таблицу.

. . . . .
. .
. .
. .
. . . . .
. . . . .
. . . . . .
Рис. Прибор для исследования смещения равновесия в газовой среде.
Таблица 2
Смещение равновесия при изменении температуры газовой смеси
|
Условия опыта |
Окраска смеси |
Концентрация
|
Смещение равновесия |
|
Т комнатная |
одинаковая |
исходная |
- |
|
Охлаждение |
менее интенсивная |
уменьшилась |
|
|
Нагревание |
более интенсивная |
увеличилась |
|
Выводы:
Исследовано смещение равновесия для реакции в жидкой фазе.
Направление смещения равновесия в опыте 1 соответствует принципу Ле-Шателье.
Исследовано смещение равновесия при изменении температуры для реакции в газовой фазе.
При нагревании равновесие в опыте 2 смещается в сторону обратной реакции, т.е. прямая реакция является экзотермической, обратная - эндотермической.





