
Новая папка / termodinamika_gotovaya11
.docxТермодинам. парам не явл - напряженность полей
2. Интенс св-вом не явл: внутр энергия
3. Внутр энерг пост: в изолированной системе
4. Для идеальн газа величина внутр энерг завис от: температуры
5.Сумма тепл и раб равна измен внутр энергии
6.Тепл эфф изобар проц без соверш друг раб, кроме рабо расш, равен: ∆Н
7. Тепл эфф изохор проц: ∆U
8.Тепл экзотерм проц изотерм усл явл велич: отрицательной
9.Тепл эндотермпроц в адиаб усл: положительная
10.Знач функц сост не завис от пути процесса
11.Энтальпия это U+PV
12. Перв начало термодин dU=∆Q+∆W
13.При
изобарн расш газатеплота равна:
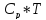
14.При изотерм расш газа тепл равна Р*∆V
15.При
изох нагр раб равна

16.Тепл эфф изоб проц равен измен энтальпии системы
17.Средн теплоемк опред уравн:Q/∆T
18.Истин
теплоемк при изох проц опред уравн:

19.Истин
теплоем при изобарн проц

20.Взаимосв
истин и средн теплоемк:

21.Колич
тепл и теплоемк:

22.Разность С(р)-С(v) для газов равна 8,31
23.Тепл эф реакц в изобарн-изотерм усл равен разн энтальпий образ. конечных и исходных веществ
24.Уравнение
расчета теплового эффекта хим. реакции:

25.Тепловой эффект реакции в водном растворе при pT=const рассчитывают по сокращ. ионному уравн.
26.Для расчета теплового эффекта реакции в водном растворе при pT=const следует использовать для ионов энтальпии образования в водном растворе
27.Уравнение
Кирхгофа для нагревания вещества в
пределах одного агрегатного состояния
при p=const:

28
Уравнение Кирхгофа для расчета теплового
эффекта хим реакции при Т>298К, p=const:

29.Количество
теплоты, затрач на нагрев некоторого
кол-ва вещ в изобарном процессе, опред
уравн:

30.Зависимость
теплоемкости от температуры для
НЕорганических вещ выражается уравн

31.
Зависимость теплоемкости от температуры
для органических вещ


32.Изменение коэффициентов a,b,c,c’ для хим реакции вычисляется по закону Келли
33.Математическое
выражение второго закона термодинамики
имеет вид:

34.Энтропия равна 0 при 0К(идеал кристалл)
35.Энтропия возрастает в процессе повышения температуры
36.При
смене агрегатного состояния т-ж-г
энтропия
увеличивается
37.Измерение энтропии при изобарном нагревании вещества определяется формулой:
38.Изменение
энтропии при фазовом переходе равно
39.Изменение энтропии при протекании химической реакции вычисляют по закону Гесса
40Изобарно-изотермический потенциал –это энергия Гиббоса
41.В изобарно-изотермических условиях реакции протекают самопроизвольно в направлении понижении энергии Гиббома
42.В изохорно-изотермических условиях реакции протекают самопроизвольно в направлении понижения энергии Гельмгольца
43.Для реакции в водном растворе изменение энергии Гиббоса можно вычислить по закону Гесса, используя энтальпии ионов в водном растворе
44.Какая функция является потенциалом в изохорно-изотермических условиях: энергия Гельмгольца F
45.Третье
начало термодинамики формулируется
так:

46.Уравнение
Гиббса-Гельмгольца для изобарного
процесса

Уравнение
Гиббса-Гельмгольца для изохорного
процесса

48.Критерием возможности протекания процесса в изобарно-изотермических условиях явл энергия Гиббоса
49.Критерием возможности протекания процесса в изохорно-изотермических условиях является энергия Гельмгольца
50.Частная
производная
 +V
+V
50) Частная производная
 1)+V
1)+V
51) Химический потенциал это:1) парциальная молярная энергия Гиббса
52) Самопроизвольный процесс протекает в направлении:2) уменьшения химического потенциала
53) Химический
потенциал это: 1)
54) Условие равновесия:
2)
55) Химический
потенциал компонента идеального газа
равен:1)

56) Химический
потенциал компонента реального газа
равен:3)
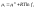
57) Изохорная теплоемкость кислорода равна:3) 2,5 R
58) μ0 – это:1) стандартный химический потенциал
59) За стандартное состояние газа принимают:1) газ при давлении 1 атм
60) Величина
фугитивности вычисляется по формуле:3)

61) В формуле для расчета фугитивности γ – это:3) коэффициент фугитивности
62) Коэффициент фугитивности – это:1) поправка на не идеальность газа
63) Коэффициент фугитивности:3) величина безразмерная
64) Не является интенсивным свойством:3) молярная теплоемкость
65) Химический
потенциал компонента идеального
раствора равен:3)

66) Химический
потенциал компонента реального раствора
равен:2)

67) Химический потенциал компонента идеального раствора возрастает пропорционально:3) логарифму мольной доли
68) Какой параметр следует подставлять вместо концентрации в выражение для хим. потенциала компонента реального раствора:4)активность
69)
Активность
компонента связана с концентрацией
выражением:4)

70) Константа равновесия не зависит:2) от концентрации
Величина константы равновесия при данной температуре и давлении определяется однозначно: стандартной энергией Гиббса
С величиной стандартной энергии Гиббса
константа равновесия связана уравнением:

Уравнение изотермы химической реакции
для идеальной системы :

При накапливании в системе продуктов реакции величина химического сродства: уменьшается
75) Для изохорно-изотермических условий по уравнению изотермы рассчитывают: энергию Гельмгольца
76) В соответствии с принципом Ле-Шателье – Брауна система реагирует на внешние воздействия следующим образом: старается уменьшить это воздействие
77) Повышение температуры: сдвигает равновесие в сторону эндотермического процесса
78) Повышение давления: сдвигает равновесие в сторону поглощения газообразных веществ
79) Разбавление газовой смеси инертными газами: не влияет на равновесие
80) В результате разбавления газовой реакционной смеси инертным газом равновесие смещается в сторону: прямой реакции
81) Уравнение изобары:

Константу равновесия реакции при
заданной температуре вычисляют по
уравнению:
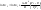
Изменение энтропии идеальной системы
равно:

Изменение энергии Гиббса процесса
процесса плавления 720г воды при Р=1атм
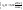 равно (кДж)
равно (кДж)
85) Химический потенциал обладает свойством стандартного, если: а=1
86)Для вычисления изменения энтропии в газофазной химической реакции при заданной температуре необходимо знать:
87) Энтропия – это логарифмическая функция: постоянство системы
88) Для идеальных
газов полный дифференциал от энергии
Гельмгольца равен:

89) Химический потенциал обладает свойством стандартного, если: а=1
90) Для двухкомпонентного сплава молярная теплоемкость равна
Уравнение
Клаузиуса-Клапейрона:

Дифференциальная
форма уравнения Клаузиуса-Клапейрона
для процесса плавления:
Дифференциальная
форма уравнения Клаузиуса-Клапейрона
для процесса изменения аллотропной
модификации

Интегральная форма уравнения Клаузиуса – Клапейрона для фазовых переходов
ж=г,
т=г.

Уравнение
Клаузиуса-Клапейрона для процессов
плавления и полиморфного превращения
 ....
....
Давление
пара в процессе сублимации чистого
вещества вычисляют по формуле:
