
Новая папка / Uch_Baza_RG-13sem_2_1
.docВопросы
к экзамену по дисциплине «Прикладная гидрогеология»
Внимание! Перечень вопросов ориентировочный, возможны ошибки и отсутствие правильных ответов.
|
Химическая термодинамика |
||||||
|
|
Термодинамическим параметром не является |
|
||||
|
|
Интенсивным свойством не является |
|
||||
|
|
Внутренняя энергия постоянна: |
|
||||
|
|
Для идеального газа величина внутренней энергии зависит от |
|
||||
|
|
Сумма теплоты и работы равна: |
|
||||
|
|
Тепловой эффект изобарного процесса без совершения другой работы, кроме работы расширения, равен: |
|
||||
|
|
Тепловой эффект изохорного процесса: |
|
||||
|
|
Теплота экзотермического процесса в изотермических условиях является величиной: |
|
||||
|
|
Теплота эндотермического процесса в адиабатических условиях: |
|
||||
|
|
Значение функции состояния не зависит от |
|
||||
|
|
Энтальпия это: |
|
||||
|
|
Первое начало термодинамики выражает формула: |
|
||||
|
|
При изобарном расширении газа теплота равна: |
|
||||
|
|
При изотермическом расширении газа теплота равна: |
|
||||
|
|
При изохорном нагревании работа равна: |
|
||||
|
|
Тепловой эффект изобарного процесса равен: |
|
||||
|
|
Средняя теплоемкость определяется уравнением: |
|
||||
|
|
Истинная теплоемкость при изохорном процессе определяется уравнением |
|
||||
|
|
Истинная теплоемкость при изобарном процессе определяется уравнением |
|
||||
|
|
Взаимосвязь истинной и средней теплоемкостей определяется уравнением |
|
||||
|
|
Количество теплоты и теплоемкость связаны уравнением |
|
||||
|
|
Разность CP – CV для газов равна, Дж/моль·К |
|
||||
|
|
Тепловой эффект реакции в изобарно-изотермических условиях равен: |
|
||||
|
|
Уравнение расчета теплового эффекта химической реакции: |
|
||||
|
|
Тепловой эффект реакции в водном растворе при pT=const рассчитывают по… |
|
||||
|
|
Для расчета теплового эффекта реакции в водном растворе при pT=const следует использовать для ионов… |
|
||||
|
|
Уравнение Кирхгофа для нагревания вещества в пределах одного агрегатного состояния при p=const… |
|
||||
|
|
Уравнение Кирхгофа для расчета теплового эффекта химической реакции при T>298K, p=const… |
|
||||
|
|
Количество теплоты, затраченное на нагревание некоторого количества вещества в изобарном процессе, определяется уравнением |
|
||||
|
|
Зависимость теплоемкости от температуры для неорганических веществ выражается уравнением: |
|
||||
|
|
Зависимость теплоемкости от температуры для органических веществ выражается уравнением: |
|
||||
|
|
Изменение коэффициентов а b c c’ для химической реакции вычисляется по закону… |
|
||||
|
|
Математическое выражение второго закона термодинамики имеет вид |
|
||||
|
|
Энтропия равна нулю при |
|
||||
|
|
Энтропия возрастает в процессе |
|
||||
|
|
При смене агрегатного состояния т"ж"г энтропия… |
|
||||
|
|
Изменение энтропии при изобарном нагревании вещества определяется формулой: |
|
||||
|
|
Изменение энтропии при фазовом переходе равно |
|
||||
|
|
Изменение энтропии при протекании химической реакции вычисляют по закону |
|
||||
|
|
Изобарно-изотермический потенциал – это… |
|
||||
|
|
В изобарно-изотермических условиях реакции протекают самопроизвольно в направлении: |
|
||||
|
|
В изохорно-изотермических условиях реакции протекают самопроизвольно в направлении: |
|
||||
|
|
Для реакции в водном растворе изменение энергии Гиббса можно вычислить |
|
||||
|
|
Какая функция является потенциалом в изохорно-изотермических условиях: |
|
||||
|
|
Третье начало термодинамики формулируется так: |
|
||||
|
|
Уравнение Гиббса-Гельмгольца для изобарного процесса |
|
||||
|
|
Уравнение Гиббса-Гельмгольца для изохорного процесса |
|
||||
|
|
Критерием возможности протекания процесса в изобарно-изотермических условиях является |
|
||||
|
|
Критерием возможности протекания процесса в изохорно-изотермических условиях является |
|
||||
|
|
Частная
производная
|
|
||||
|
|
Химический потенциал это: |
|
||||
|
|
Самопроизвольный процесс протекает в направлении |
|
||||
|
|
Химический потенциал это |
|
||||
|
|
Условие равновесия |
|
||||
|
|
Химический потенциал компонента идеального газа равен: |
|
||||
|
|
Химический потенциал компонента реального газа равен: |
|
||||
|
|
Изохорная теплоемкость кислорода равна: |
|
||||
|
|
μ0 – это |
|
||||
|
|
За стандартное состояние газа принимают |
|
||||
|
|
Величина фугитивности вычисляется по формуле |
|
||||
|
|
В формуле для расчета фугитивности γ – это |
|
||||
|
|
Коэффициент фугитивности – это |
|
||||
|
|
Коэффициент фугитивности |
|
||||
|
|
Не является интенсивным свойством |
|
||||
|
|
Химический потенциал компонента идеального раствора равен: |
|
||||
|
|
Химический потенциал компонента реального раствора равен: |
|
||||
|
|
Химический потенциал компонента идеального раствора возрастает пропорционально: |
|
||||
|
|
Какой параметр следует подставлять вместо концентрации в выражение для хим. потенциала компонента реального раствора: |
|
||||
|
|
Активность компонента связана с концентрацией выражением |
|
||||
|
|
Константа равновесия не зависит: |
|
||||
|
|
Величина константы равновесия при данной температуре и давлении определяется однозначно: |
|
||||
|
|
С величиной стандартной энергии Гиббса константа равновесия связана уравнением |
|
||||
|
|
Уравнение изотермы химической реакции для идеальной системы |
|
||||
|
|
При накапливании в системе продуктов реакции величина химического сродства |
|
||||
|
|
Для изохорно-изотермических условий по уравнению изотермы рассчитывают |
|
||||
|
|
В соответствии с принципом Ле-Шателье – Брауна система реагирует на внешние воздействия следующим образом: |
|
||||
|
|
Повышение температуры: |
|
||||
|
|
Повышение давления: |
|
||||
|
|
Разбавление газовой смеси инертными газами |
|
||||
|
|
В результате разбавления газовой реакционной смеси инертным газом равновесие смещается в сторону: |
|
||||
|
|
Уравнение изобары: |
|
||||
|
|
Константу равновесия реакции при заданной температуре вычисляют по уравнению |
|
||||
|
|
Изменение энтропии идеальной системы равно |
|
||||
|
|
Изменение
энергии Гиббса процесса процесса
плавления 720г воды при Р=1атм
|
|
||||
|
|
Химический потенциал обладает свойством стандартного, если |
|
||||
|
|
Для вычисления изменения энтропии в газофазной химической реакции при заданной температуре необходимо знать |
|
||||
|
|
Энтропия – это логарифмическая функция |
|
||||
|
|
Для идеальных газов полный дифференциал от энергии Гельмгольца равен |
|
||||
|
|
Химический потенциал обладает свойством стандартного, если |
|
||||
|
|
Для двухкомпонентного сплава молярная теплоемкость равна |
|
||||
|
|
Для двухатомных газов коэффициент адиабаты равен |
|
||||
|
|
Для трёхатомных газов коэффициент адиабаты равен |
1. 1,67 2. 1,40 3. 1,33 4. 1,2 |
||||
|
|
Функцией состояния системы не является: |
|
||||
|
|
Для расчета теплоемкости твердых тел используют: |
Уравнение Неймана и Коопа Функции Эйнштейна Коэффициенты Темкина и Шварцмана Формулу Кирхгофа |
||||
|
|
Изохорная теплоемкость кислорода равна: |
1,5 R 26 Дж/моль×К 2,5 R 3 R |
||||
|
|
Для какой из функций может быть рассчитана абсолютная величина |
S A U H |
||||
|
|
Изобарная теплоемкость аргона равна: |
1. 1,5 R 2. 26 Дж/моль×К 3. 2,5 R 4. 3 R |
||||
|
Формальная кинетика |
||||||
|
98. |
На скорость химической реакции не влияет: |
|
||||
|
99. |
Скорость гетерогенной химической реакции – это изменение действующей массы отнесенное к |
|
||||
|
100. |
Реакция типа
А→
В→
|
|
||||
|
101. |
Если
40< |
|
||||
|
102. |
Элементарная реакция идет в … стадий |
|
||||
|
103. |
Понятие «молекулярность реакции» применимо к процессам |
|
||||
|
104. |
Молекулярность реакции H2 + I2 = 2HI, считая ее элементарной, равна |
|
||||
|
105. |
Молекулярность реакции СаО + СО2 = СаСО3, считая ее элементарной |
|
||||
|
106. |
Молекулярность реакции 3H2 + N2 = 2NH3, считая ее элементарной |
|
||||
|
107. |
Во сколько раз возрастет скорость прямой элементарной газофазной реакции А + 2В = D при увеличении давления в 2 раза? |
|
||||
|
108. |
Скорость реакции пропорциональна произведению концентраций реагентов в степенях, равных |
|
||||
|
108. |
Для реакции (считая ее элементарной) 3H2 + N2 = 2NH3 скорость прямого процесса определяется уравнением: |
|
||||
|
109. |
Во сколько раз уменьшится скорость реакции: Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S при разбавлении реагирующей смеси в 5 раз? |
|
||||
|
110. |
Порядок реакции по данному реагенту равен для формально простой реакции |
|
||||
|
111. |
Для реакции (считая ее элементарной) H2 + I2 = 2HI скорость прямого процесса определяется уравнением: |
|
||||
|
112. |
Как изменится скорость реакции CO(Г) + Н2О(Г) = СО2(Г) + Н2(Г) при увеличении концентрации Н2О в 5 раз? |
|
||||
|
113. |
Как изменится скорость прямой реакции CO(Г) + Н2О(Г) = СО2(Г) + Н2(Г) при увеличении концентрации Н2 в 5 раз? |
|
||||
|
114. |
Порядок реакции равен: |
|
||||
|
115. |
Константа скорости реакции зависит: |
|
||||
|
116 |
Зависимость концентрации от времени в реакции первого порядка описывается уравнением: |
|
||||
|
117 |
Зависимость концентрации от времени в реакции второго порядка описывается уравнением: |
|
||||
|
118 |
Зависимость концентрации от времени в реакции третьего порядка описывается уравнением: |
|
||||
|
119. |
Уравнение константы скорости реакции первого порядка |
|
||||
|
120. |
Уравнение константы скорости реакции второго порядка |
|
||||
|
121. |
При увеличении концентрации исходных веществ в 2 раза константа скорости реакции первого порядка |
|
||||
|
122. |
Реакции первого порядка соответствует линейная зависимость в координатах: |
|
||||
|
123. |
Реакции второго порядка соответствует линейная зависимость в координатах: |
|
||||
|
124. |
Реакции третьего порядка соответствует линейная зависимость в координатах: |
|
||||
|
125. |
При увеличении температуры на 10° скорость химических реакций возрастает в 2 – 4 раза» |
|
||||
|
126. |
Математическая формула правила Вант-Гоффа |
|
||||
|
127. |
Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 20°С,если температурный коэффициент равен 2? |
|
||||
|
128. |
Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 30°С,если температурный коэффициент равен 2? |
|
||||
|
129. |
Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 10°С,если температурный коэффициент равен 2? |
|
||||
|
130. |
Уравнение зависимости константы скорости реакции от температуры: |
|
||||
|
131. |
Энергия активации это: |
|
||||
|
132. |
Энергию активации определяют по угловому коэффициенту прямой в координатах: |
|
||||
|
133. |
Зависимость
времени полупревращения имеет вид
|
|
||||
|
134. |
Период полупревращения в реакции второго порядка равен: |
1.
2.
3. 4
|
||||
|
135. |
Для реакции нулевого порядка размерность константы скорости реакции имеет вид |
1. безразмерная
2.
3.
4.
|
||||
|
136. |
Катализаторы |
|
||||
|
137. |
|
|
||||
|
Фазовые равновесия |
||||||
|
138. |
Уравнение Клаузиуса-Клапейрона: |
|
||||
|
139. |
Дифференциальная форма уравнения Клаузиуса-Клапейрона для процесса плавления |
|
||||
|
140. |
Дифференциальная форма уравнения Клаузиуса-Клапейрона для процесса изменения аллотропной модификации |
|
||||
|
141. |
Интегральная форма уравнения Клаузиуса – Клапейрона для фазовых переходов ж=г, т=г. |
|
||||
|
142 |
Уравнение Клаузиуса-Клапейрона для процессов плавления и полиморфного превращения |
|
||||
|
143. |
Давление пара в процессе сублимации чистого вещества вычисляют по формуле: |
|
||||
|
144. |
На
диаграмме точка 1 это:
|
|
||||
|
145. |
На следующей диаграмме состояния воды
какому равновесному состоянию отвечает линия ОС |
|
||||
|
146. |
На следующей диаграмме состояния воды
какому равновесному состоянию отвечает линия ОА |
|
||||
|
147. |
Конгруэнтно плавящимся называют соединение |
|
||||
|
148. |
Инконгруэнтно плавящимся называют соединение |
1. плавящееся без разложения 2. плавящееся при температуре ниже эвтектики 3. разлагающееся по перитектической реакции 4. плавящееся экзотермически
|
||||
|
149. |
Определить эвтектический состав (% В)
|
|
||||
|
150. |
Указать фазовый состав в точке 2 |
|
||||
|
151. |
Определить перитектический состав жидкостии (%В) |
|
||||
|
152. |
Сколько степеней свободы в точке 3? |
|
||||
|
153. |
Указать температуру начала и конца кристаллизации точки 5 |
|
||||
|
154. |
Указать состав жидкой фазы в точке 2 |
|
||||
|
155. |
Указать температуру начала и конца кристаллизации точки 1 |
|
||||
|
156. |
Фазовый состав точки 5 |
|
||||
|
157. |
Состав жидкой фазы в точке 5 (в % по В)? |
|
||||
|
158. |
Монотропный фазовый переход |
|
||||
|
159. |
Индивидуальные вещества наименьшего числа которых необходимо и достаточно для образования всех фаз системы называют |
|
||||
|
160. |
В двухкомпонентной системе жидкость, находящаяся в равновесии с двумя твердыми фазами одна из которых в ней растворяется, а другая из нее кристаллизируется, называется: |
|
||||
|
161. |
Максимальное число степеней свободы в трехкомпонентной конденсированной системе равно |
|
||||
|
162. |
Максимальное число степеней свободы в однокомпонентной системе равно |
|
||||
|
163. |
Для двухкомпонентной конденсированной системы максимальное число фаз находящихся в равновесии при Р=const равно |
|
||||
|
164. |
Правило фаз Гиббса выражается уравнением |
1. F = K + n + Ф 2. F = Ф + n – K 3. F = K - n + Ф 4. F = K + n – Ф |
||||
|
165. |
Для однокомпонентных систем согласно принципа соответствия равновесию двух фаз отвечает |
|
||||
|
166. |
Для однокомпонентных систем согласно принципа соответствия равновесию трёх фаз отвечает |
1.поверхность 2.плоскость 3.точка 4.линия |
||||
|
167. |
Число компонентов системы равно |
|
||||
|
168. |
Гомогенной называется система |
|
||||
|
169/ |
Энантиотропный переход |
|
||||
|
170. |
В двухкомпонентной системе жидкость, находящаяся в равновесии с двумя твердыми фазами одна из которых в ней растворяется, а другая из нее кристаллизируется, называется: |
1.полиморфной 2.перитектической 3.гетерогенной 4.дистектической
|
||||
|
171. |
Какая площадь на диаграмме отвечает гомогенной системе? |
|
||||
|
172. |
Сколько линий моновариантного равновесия на диаграмме?
|
|
||||
|
173. |
Растворимость какого соединения на диаграмме выше?
|
|
||||
|
174. |
Сколько полей на диаграмме отвечают гомогенной системе?
|
|
||||
|
175. |
Сколько полей бивариантного равновесия фаз на диаграмме?
|
|
||||
|
176. |
Растворимость какого соединения на диаграмме выше?
|
|
||||
|
177. |
Сколько фаз находятся в равновесии в точке Е1?
|
|
||||
|
178. |
Состав поля 4?
|
|
||||
|
179. |
Состав поля 3?
|
|
||||
|
180. |
Сколько полей диаграммы содержат 3 фазы?
|
|
||||
|
181. |
Физический смысл линии bE
|
|
||||
|
182. |
Состав поля 3?
|
|
||||
|
Дисперсные системы |
||||||
|
182 |
Внутреннее давление – это |
|
||||
|
183. |
Внутреннее давление зависит от… |
|
||||
|
184. |
Для образования межфазной поверхности надо |
|
||||
|
185. |
Поверхностная энергия – это |
|
||||
|
186. |
Поверхностный слой – это… |
|
||||
|
187. |
Поверхностное натяжение характеризует |
|
||||
|
188. |
Поверхностное натяжение это: |
|
||||
|
189. |
Поверхностное натяжение – это работа, которую нужно совершить |
|
||||
|
190. |
Поверхностное натяжение с ростом температуры |
|
||||
|
191. |
Поверхностная активность это |
|
||||
|
192. |
Для поверхностно-активных веществ (ПАВ) справедливо утверждение: |
|
||||
|
193. |
К свойствам поверхностно активных веществ (ПАВ) не относится |
|
||||
|
194. |
Условие самопроизвольности адсорбции |
|
||||
|
195. |
Работу когезии необходимо затратить в равновесном изотермическом процессе для… |
|
||||
|
196. |
Работа когезии вычисляется по формуле |
|
||||
|
197. |
Явление когезии – это … |
|
||||
|
198. |
Явление адгезии – это |
|
||||
|
199. |
Работу адгезии необходимо затратить в равновесном изотермическом процессе для… |
|
||||
|
200. |
Работу адгезии вычисляют по уравнению Дюпре: |
|
||||
|
201. |
Смачивание – это поверхностное явление, заключающееся во взаимодействии |
|
||||
|
202. |
Смачивание характеризует |
|
||||
|
203. |
Косинус краевого угла – это (уравнение Юнга) |
|
||||
|
204. |
При помещении капли воды на гидрофильную поверхность |
|
||||
|
205. |
При помещении капли воды на гидрофобную поверхность |
|
||||
|
206. |
Лучше смачивает та жидкость, у которой |
|
||||
|
207. |
Давление пара жидкости выше |
|
||||
|
208. |
При молекулярной адсорбции в поверхностный слой переходит тот компонент, который |
|
||||
|
209. |
При химической адсорбции в поверхностный слой переходит тот компонент, который |
|
||||
|
210. |
Увеличение температуры приводит к |
|
||||
|
211. |
Изотерма адсорбции Гиббса для поверхности раздела фаз жидкость/газ представлена следующим уравнением: |
|
||||
|
212. |
Интегральная форма изотермы адсорбции Гиббса для идеальных и предельно разбавленных растворов |
|
||||
|
213. |
Увеличение длины углеводородного радикала приводит к |
|
||||
|
214. |
Правило Дюкло-Траубе |
|
||||
|
215. |
Уравнение Шишковского |
|
||||
|
217. |
Уравнение изотермы адсорбции Ленгмюра |
|
||||
|
218. |
Адсорбция на границе Т-Г описывается уравнением Фрейндлиха: |
|
||||
|
219. |
В основе ионной (химической) адсорбции находится |
|
||||
|
220. |
Сущность ионообменного механизма заключается в |
|
||||
|
221. |
Иониты - это твердые вещества, содержащие |
|
||||
|
222. |
При одинаковом заряде ионов химическая адсорбция усиливается при |
|
||||
|
223. |
Химическая адсорбция из водных растворов усиливается при |
|
||||
|
224. |
В каком из рядов катионов адсорбция увеличивается? |
|
||||
|
225 |
В каком из рядов анионов адсорбция увеличивается? |
|
||||
|
|
Ионообменную адсорбцию используют для извлечения |
|
||||
|
|
Плоскость скольжения находится |
|
||||
|
|
Электрокинетический потенциал возникает |
|
||||
|
|
Электрокинетический потенциал уменьшается: |
|
||||
|
|
При добавлении индифферентного электролита, один из ионов которого одинаков с противоионами ДЭС электрокинетический потенциал |
|
||||
|
|
Электроосмос это: |
|
||||
|
|
Электрофорез – это |
|
||||
|
|
Коагуляцию вызывают ионы, которые |
|
||||
|
|
Порогом коагуляции называют |
|
||||
|
|
Правило Шульце-Гарди |
|
||||
|
|
Величина порога коагуляции вычисляют по формуле |
|
||||
|
Методы исследования минеральных систем |
||||||
|
311. |
Лакмус в кислой среде |
|
||||
|
|
Лакмус в щелочной среде |
1. Красный 2. Синий 3. Желтый 4. Бесцветный |
||||
|
|
Метилоранж в кислой среде |
1. Красный 2. Синий 3. Желтый 4. Бесцветный |
||||
|
|
Фенолфталеин в кислой среде |
1. Красный 2. Синий 3. Желтый 4. Бесцветный |
||||
|
|
Фенолфталеин в щелочной среде |
|
||||
|
|
В кислотно-основной схеме анализа к 1-ой аналитической группе относится катион |
|
||||
|
|
Красную окраску в растворе имеет комплекс |
|
||||
|
|
Синюю окраску в растворе имеет комплекс |
|
||||
|
|
Осадок йодида свинца имеет цвет |
1. белый 2. синий 3. зеленый 4. желтый |
||||
|
|
Катион Zn+2 в водных растворах имеет цвет |
1. желтый 2. синий 3. зеленый 4. бесцветный |
||||
|
|
Для никеля характерна степень окисления… |
|
||||
|
|
В результате качественной реакции |
|
||||
|
|
Специфическими качественными реакциями открывают |
|
||||
|
|
Групповой реагент - |
|
||||
|
|
В кислотно-основном систематическом анализе выделяют |
|
||||
|
|
Реагентом на ион железа (3+) является |
|
||||
|
|
Реагентом на ион меди (2+) является |
|
||||
|
|
В кислотно-основной схеме анализа к 4-ой аналитической группе не относится катион |
|
||||
|
|
В кислотно-основной схеме анализа ко 2-ой аналитической группе относится катион |
|
||||
|
|
К 4-ой аналитической группе относится катион |
|
||||
|
|
Катионы 5-ой аналитической группы выделяют действием |
|
||||
|
|
Катионы кальция и бария можно разделить действием |
|
||||
|
|
Присутствие хлоридов в водном растворе можно определить по образованию белого осадка с: |
|
||||
|
|
Белый осадок при добавлении раствора нитрата бария образует следующий комплекс |
|
||||
|
|
Определить карбонатную породу можно |
|
||||
|
|
Присутствие железа (III) в водном растворе можно определить при помощи: |
|
||||
|
|
Присутствие сульфатов в водном растворе можно определить по образованию белого осадка с |
|
||||
|
|
Сульфиды активных металлов можно определить при действии на них сильной кислоты. При этом: |
|
||||
|
|
Действие ауринтрикарбоната аммония в ацетатном буфере является качественной реакцией на катион |
|
||||
|
|
Действие гидрофосфата натрия в аммонийном буфере является качественной реакцией на катион |
|
||||
|
|
Осадок K2Na[Co(NO2)6] имеет цвет |
|
||||
|
|
Осадок Co[Hg(CNS)4] имеет цвет |
|
||||
|
|
В аммонийном буфере проводят следующую аналитическую реакцию: |
|
||||
|
|
Осадок PbCrO4 имеет цвет |
|
||||
|
|
Осадок диметилглиоксимата никеля имеет цвет |
|
||||
|
|
Блок «Аналитическая химия» Раздел 8.2 «Качественный анализ» Уровень 2 |
|
||||
|
|
Величина рН в ацетатном буфере при эквимолярных количествах компонентов приближенно равна |
|
||||
|
|
Величина рН в смеси равных объемов 0,1 н. растворов NH4OH и (NH4)2SO4 приближенно равна |
|
||||
|
|
Величина рН в смеси растворов СН3СООН (избыток) + NaOH приближенно равна |
1. 3 2. 5 3. 7 4. 9 |
||||
|
|
Величина рН в смеси растворов NH4Cl (избыток) + NaOH приближенно равна |
1. 3 2. 5 3. 7 4. 9 |
||||
|
|
Лакмус в кислой среде |
|
||||
|
|
Ацетатный буфер используют |
|
||||
|
|
Аммонийный буфер используют |
1. В качественной реакции на катион магния с гидрофосфатом натрия 2. При разделении катионов 3-ей и 4-ой аналитических групп 3. В качественной реакции на катион никеля с диметилглиоксимом 4. В качественной реакции на катион алюминия с ауринтрикарбонатом аммония |
||||
|
|
Лакмус в щелочной среде |
1. Красный 2. Синий 3. Желтый 4. Бесцветный |
||||
|
|
Метилоранж в кислой среде |
1. Красный 2. Синий 3. Желтый 4. Бесцветный |
||||
|
|
Фенолфталеин в кислой среде |
1. Красный 2. Синий 3. Желтый 4. Бесцветный |
||||
|
|
Фенолфталеин в щелочной среде |
|
||||
|
|
Фенолфталеин изменяет окраску от бесцветной к розовой при рН больше |
1. 5,1 2. 7,0 3. 8,3 4. 9,5 |
||||
|
|
Метилоранж при рН больше 5 |
1. Красный 2. Оранжевый 3. Желтый 4. Малиновый |
||||
|
|
В кислотно-основной схеме анализа к 4-ой аналитической группе не относится катион |
|
||||
|
|
В кислотно-основной схеме анализа ко 2-ой аналитической группе относится катион |
|
||||
|
|
В кислотно-основной схеме анализа к 3-ей аналитической группе относится катион |
1. Cd2+ 2. Hg2+ 3. Ca2+ 4. Zn2+ |
||||
|
|
В кислотно-основной схеме анализа к 5-ой аналитической группе относится катион |
1. Cd2+ 2. Мg2+ 3. Ca2+ 4. Zn2+ |
||||
|
|
В кислотно-основной схеме анализа к 1-ой аналитической группе относится катион |
|
||||
|
|
Красную окраску в растворе имеет комплекс |
|
||||
|
|
Синюю окраску в растворе имеет комплекс |
|
||||
|
|
Зеленую окраску в растворе имеет комплекс |
|
||||
|
|
Раствор следующего комплекса не окрашен |
|
||||
|
|
Осадок Co[Hg(CNS)4] имеет цвет |
|
||||
|
|
Осадок K2Na[Co(NO2)6] имеет цвет |
|
||||
|
|
Осадок йодида свинца имеет цвет |
1. белый 2. синий 3. зеленый 4. желтый |
||||
|
|
Осадок сульфида кадмия имеет цвет |
|
||||
|
|
Осадок хлоридов катионов 2-ой аналитической группы имеет цвет |
|
||||
|
|
Катионы 1-ой и 2-ой аналитических групп разделяют действием раствора |
|
||||
|
|
Групповым реагентом катионов 3-ей аналитической группы является раствор |
1. 2 н. H2SO4 2. 6 н. NaOH 3. 2 н. HCl 4. NH4OH (концентрированного) |
||||
|
|
Групповым реагентом катионов 4-ой аналитической группы является раствор |
|
||||
|
|
Катионы 5-ой и 6-ой аналитических групп разделяют действием раствора |
1. 2 н. H2SO4 2. 6 н. NaOH 3. 2 н. HCl 4. NH4OH (концентрированного) |
||||
|
|
Катионы серебра и ртути (I) разделяют |
1. Промыванием горячей водой 2. Действием концентрированного аммиака 3. В аммиачном буфере 4. Действием сульфата натрия в щелочной среде |
||||
|
|
Катионы свинца выделяют из осадка хлоридов 2-ой аналитической группы |
1. Промыванием горячей водой 2. Действием концентрированного аммиака 3. Действием тиосульфата натрия в кислой среде 4. В аммиачном буфере |
||||
|
|
Катионы железа (3+) и магния разделяют |
1. Промыванием горячей водой 2. Действием концентрированного аммиака 3. Действием тиосульфата натрия в кислой среде 4. В аммиачном буфере |
||||
|
|
Катионы меди и ртути выделяют из раствора катионов 6-ой аналитической группы |
1. Промыванием горячей водой 2. Действием концентрированного аммиака 3. Действием тиосульфата натрия в кислой среде 4. В аммиачном буфере |
||||
|
|
Катионы цинка и алюминия можно разделить действием |
|
||||
|
|
В кислотно-основной схеме анализа к 6-ой аналитической группе относится катион |
1. Hg22+
|
||||
|
|
Осадок диметилглиоксимата никеля имеет цвет |
|
||||
|
|
Действие ауринтрикарбоната аммония в ацетатном буфере является качественной реакцией на катион |
|
||||
|
|
Действие хромата калия в нейтральной среде является качественной реакцией на катион |
1. алюминия 2. цинка 3. меди 4. свинца |
||||
|
|
Катион натрия обнаруживают по образованию белого мелкокристаллического осадка при действии раствора |
1. 2 н. серной кислоты 2. Na3[Co(NO2)6 при рН=5-7 3. KH2SbO4 при рН=7-8 4. (NH4)2[Hg(CNS)4] в ацетатном буфере |
||||
|
|
Катион железа (3+) обнаруживают по образованию осадка берлинской лазури при действии раствора |
1. 2 н. серной кислоты 2. Na3[Co(NO2)6 при рН=5-7 3. KH2SbO4 при рН=7-8 4. K4[Fe(CN)6] |
||||
|
|
Катион калия обнаруживают по образованию желтого осадка при действии раствора |
1. 2 н. серной кислоты 2. Na3[Co(NO2)6 при рН=5-7 3. KH2SbO4 при рН=7-8 4. (NH4)2[Hg(CNS)4] в ацетатном буфере |
||||
|
|
Катион кобальта (2+) обнаруживают по образованию синего крупнокристаллического игольчатого осадка при действии раствора |
1. 2 н. серной кислоты 2. Na3[Co(NO2)6 при рН=5-7 3. KH2SbO4 при рН=7-8 4. (NH4)2[Hg(CNS)4] в ацетатном буфере |
||||
|
|
Катион бария обнаруживают по образованию белого осадка при действии раствора |
1. 2 н. серной кислоты 2. Na3[Co(NO2)6 при рН=5-7 3. KH2SbO4 при рН=7-8 4. (NH4)2[Hg(CNS)4] в ацетатном буфере |
||||
|
|
Блок «Аналитическая химия» Раздел 9.1 «Количественный анализ» Уровень 1 |
|
||||
|
|
В основе гравиметрического анализа лежат реакции |
|
||||
|
|
В требования к весовой форме не входит |
|
||||
|
|
В требования к осаждаемой форме не входит |
|
||||
|
|
Требования к осадителю следующие: (лишнее - правильный ответ) |
|
||||
|
|
Для весового анализа железа в смеси железо – медь в качестве осадителя можно использовать |
|
||||
|
|
Аморфные осадки лучше получать |
|
||||
|
|
К операциям весового анализа не относится |
|
||||
|
|
Кристаллические осадки лучше получать |
|
||||
|
|
При осаждении используют избыток осадителя для |
|
||||
|
|
Весовой формой при анализе железа является |
|
||||
|
|
Осаждаемой формой при анализе железа является |
|
||||
|
|
Хорошо фильтруемый аморфный осадок получают в результате |
|
||||
|
|
Весовая форма должна отвечать следующему требованию: |
|
||||
|
|
Весовому определению железа путем осаждения аммиаком мешает катион |
|
||||
|
|
Хорошо фильтруемый кристаллический осадок получают |
|
||||
|
|
Весовому определению бария путем осаждения в виде сульфата мешает катион |
|
||||
|
|
Промывать осадок Fe(OH)3 следует слабым раствором |
|
||||
|
|
Промывать осадок BaSO4 следует слабым раствором |
|
||||
|
|
Требования к реакциям, используемым в объемном анализе (лишнее - правильный ответ) |
|
||||
|
|
Титрант – это |
|
||||
|
|
Как чаще всего выражают концентрацию раствора в титриметрическом анализе |
|
||||
|
|
Точка эквивалентности – это |
|
||||
|
|
Что такое кривая титрования в кислотно-основном методе? |
|
||||
|
|
Что такое скачок титрования в кислотно-основном методе? |
|
||||
|
|
К видам объемного анализа не относится |
|
||||
|
|
Как практически фиксируется точка эквивалентности в кислотно-основном титровании? |
|
||||
|
|
Кислотно-основной индикатор – это |
|
||||
|
|
Изменение окраски кислотно-основного индикатора связано с |
|
||||
|
|
Как определяют точку эквивалентности при перманганатометрическом титровании? |
|
||||
|
|
Как определяют точку эквивалентности при иодометрическом титровании |
|
||||
|
|
При иодометрическом анализе в качестве титранта используют раствор |
|
||||
|
|
Точку эквивалентности при комплексонометрическом титровании определяют при помощи |
|
||||
|
|
Что такое жесткость воды? |
|
||||
|
|
Какой индикатор используется при определении жесткости воды? |
|
||||
|
|
Комплексонометрическое титрование основано на том, что |
|
||||
|
|
В комплексонометрическом титровании в качестве титранта используют раствор |
|
||||
|
|
Определение содержания йода возможно следующим титрантом |
|
||||
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
||||
|
|
Данная кривая описывает титрование кислотой следующего основания: |
|
||||
|
|
|
|
||||
|
|
В каком из перечисленных титрований точка эквивалентности соответствует рН 7 |
|
||||
|
|
Для определения конца титрования Na2CO3+HCl пригоден |
|
||||
|
|
Метод аргентометрии относится к видутитрования… |
|
||||
|
|
Эквивалентная масса перманганата калия при окислительно-восстановительном титровании в кислой среде равна |
|
||||
|
|
Эквивалентная масса дихромата калия при окислительно-восстановительном титровании в кислой среде равна |
|
||||
|
|
Эквивалентная масса железа (2+) при окислительно-восстановительном титровании равна |
|
||||
|
|
При перманганатометрическом определении железа конец титрования определяют по |
|
||||
|
|
При иодометрическом определении меди конец титрования определяют по |
|
||||
|
|
Точку эквивалентности при определении жесткости воды устанавливают по |
|
||||
|
|
На титрование аликвоты кислоты объемом 10 мл израсходовали 5 мл 0,1 н. раствора щелочи. Концентрация кислоты равна: |
|
||||
|
|
На титрование аликвоты объемом 10 мл 0,1 н. раствора хлорида кальция израсходовали 20 мл раствора трилона Б. Концентрация трилона Б равна: |
|
||||
|
|
На титрование аликвоты гидроксида натрия объемом 10 мл пошло 10 мл 0,1 н. раствора соляной кислоты. Определить концентрацию NaOH в г/л |
|
||||
|
|
Блок «Аналитическая химия» Раздел 9.2 «Количественный анализ» Уровень 2 |
|
||||
|
|
Определение содержания йода возможно следующим титрантом |
|
||||
|
|
Весовому определению железа путем осаждения аммиаком мешает катион |
|
||||
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
||||
|
|
При титровании сильной кислоты щелочью эквивалентная точка лежит при рН |
|
||||
|
|
При титровании слабой кислоты щелочью эквивалентная точка лежит при рН |
1. Около 5 2. 7 3. Около 9 4. 1 |
||||
|
|
При титровании слабого основания кислотой эквивалентная точка лежит при рН |
1. Около 5 2. 7 3. Около 9 4. 1 |
||||
|
|
При титровании сильного основания кислотой эквивалентная точка лежит при рН |
1. Около 5 2. 7 3. Около 9 4. 1 |
||||
|
|
Две эквивалентных точки наблюдаются при титровании кислотой раствора следующей соли |
|
||||
|
|
Титрование слабого основания кислотой ведут с индикатором |
1. эриохром 2. фенолфталеин 3. лакмус 4. метилоранж |
||||
|
|
Титрование слабой кислоты щелочью ведут с индикатором |
1. эриохром 2. фенолфталеин 3. лакмус 4. метилоранж |
||||
|
|
Эквивалентная масса перманганата калия при окислительно-восстановительном титровании в кислой среде равна |
1. Молярной массе М 2. М/2 3. М/3 4. М/5 |
||||
|
|
Эквивалентная масса дихромата калия при окислительно-восстановительном титровании в кислой среде равна |
|
||||
|
|
Эквивалентная масса меди при йодометрическом определении равна |
1. Молярной массе М 2. М/2 3. М/3 4. М/4 |
||||
|
|
Эквивалентная масса железа при титровании раствором перманганата калия равна |
|
||||
|
|
Содержание кальция в водном растворе определяют титрованием |
1. перманганатом калия 2. дихроматом калия 3. раствором щелочи 4. трилоном Б в щелочной среде |
||||
|
|
Содержание магния в водном растворе определяют титрованием |
1. перманганатом калия 2. дихроматом калия 3. раствором щелочи 4. трилоном Б в аммиачном буфере |
||||
|
|
Содержание железа (2+) в водном растворе определяют титрованием |
1. перманганатом калия 2. тиосульфатом натрия 3. раствором щелочи 4. трилоном Б в щелочной среде |
||||
|
|
Содержание кальция в водном растворе определяют комплексонометрическим титрованием с индикатором |
1. эриохром 2. фенолфталеин 3. лакмус 4 мурексид |
||||
|
|
Содержание цинка в водном растворе определяют комплексонометрическим титрованием с индикатором |
1. эриохром 2. фенолфталеин 3. лакмус 4. метилоранж |
||||
|
|
Расчет
результатов кислотно-основного
титрования ведут по формуле |
|
||||
|
|
Расчет
результатов окислительно-восстановительного
титрования ведут по формуле |
1. Молярная концентрация 2. Нормальная концентрация 3. Концентрация в электрохимических эквивалентах на литр раствора 4. Концентрация в г/л |
||||
|
|
Расчет
результатов трилонометрического
титрования ведут по формуле |
1. Молярная концентрация 2. Нормальная концентрация 3. Моляльная концентрация 4. Концентрация в электрохимических эквивалентах на литр раствора |
||||
|
|
На титрование аликвоты кислоты объемом 10 мл израсходовали 5 мл 0,1 н. раствора щелочи. Концентрация кислоты равна: |
|
||||
|
|
На титрование аликвоты объемом 10 мл 0,1 н. раствора хлорида кальция израсходовали 20 мл раствора трилона Б. Концентрация трилона Б равна: |
|
||||
|
|
20 мл 0,2 н. раствора соляной кислоты требуют для нейтрализации 10 мл раствора Ва(ОН)2. Молярная концентрация гидроксида бария равна |
1. 0,025 М 2. 0,05 М 3. 0,1 М 4. 0,2 М |
||||
|
|
Рассчитать молярную концентрацию серной кислоты , если на титрование аликвоты 5 мл израсходовали 20 мл 0,1 н. раствора едкого натра. Ответ: |
1. 0,025 М 2. 0,05 М 3. 0,1 М 4. 0,2 М |
||||
|
|
На титрование аликвоты раствора Na2CO3 объемом 10 мл по метилово- му оранжевому израсходовали 5 мл 0,2 н. раствора соляной кислоты. Молярная концентрация соды равна |
1. 0,025 М 2. 0,05 М 3. 0,1 М 4. 0,2 М |
||||
|
|
На титрование аликвоты объемом 10 мл раствора соли цинка израсходовали 20 мл 0,1 М раствора трилона Б. Нормальная концентрация цинка равна |
1. 0,025 М 2. 0,05 М 3. 0,1 М 4. 0,2 М 5. 0,4 М |
||||
|
|
На титрование пробы воды объемом 50 мл израсходовали 10 мл 0,05 М раствора трилона Б. Жесткость воды в миллиэквивалентах на литр равна |
1. 5 2. 10 3. 15 4. 20 |
||||
|
|
На титрование аликвоты 10 мл раствора FeSO4 израсходовали 20 мл 0,1 н. раствора перманганата калия. Молярная концентрация железа в растворе равна |
1. 0,025 М 2. 0,05 М 3. 0,1 М 4. 0,2 М |
||||
|
170. |
В окислительно- восстановительном титровании не используется следующий титрант |
1. NH4VO3 2. KMnO4 3. K2Cr2O7 4. Na2SO4 |
||||



















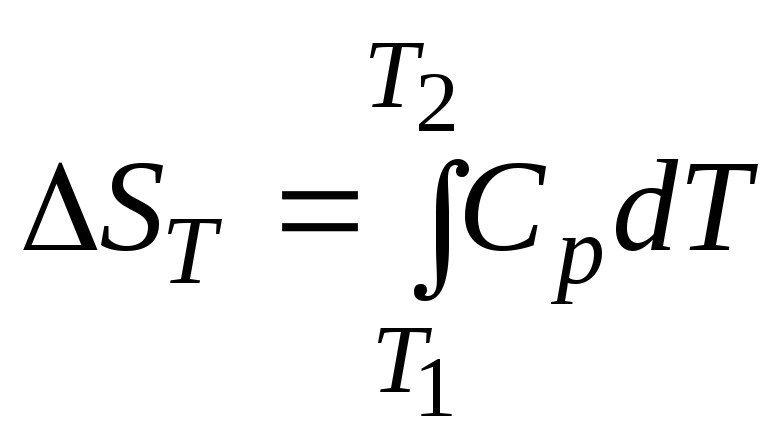




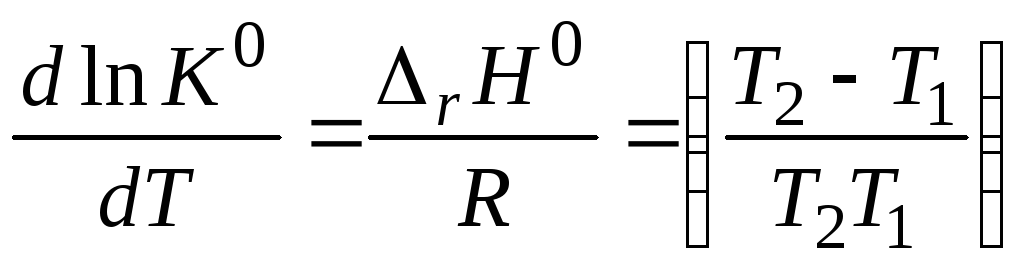



























 Данная
кривая описывает титрование щелочью
следующей кислоты:
Данная
кривая описывает титрование щелочью
следующей кислоты: Данная
кривая описывает титрование щелочью
следующей кислоты:
Данная
кривая описывает титрование щелочью
следующей кислоты: Данная
кривая описывает титрование кислотой
раствора следующей соли:
Данная
кривая описывает титрование кислотой
раствора следующей соли:
 Данная
кривая описывает титрование кислотой
следующего основания:
Данная
кривая описывает титрование кислотой
следующего основания: Данная
кривая описывает титрование щелочью
следующей кислоты:
Данная
кривая описывает титрование щелочью
следующей кислоты: Данная
кривая описывает титрование щелочью
следующей кислоты:
Данная
кривая описывает титрование щелочью
следующей кислоты: Данная
кривая описывает титрование кислотой
следующего основания:
Данная
кривая описывает титрование кислотой
следующего основания: Данная
кривая описывает титрование кислотой
следующего основания:
Данная
кривая описывает титрование кислотой
следующего основания: