
Реферат ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
.docФедеральное агентство по образованию
Государственное учреждение профессионального высшего образования
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)
Кафедра общей и физической химии
РЕФЕРАТ
ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
Выполнил студент гр. ЭП-04 ___________________ /Федотов А.А./
(подпись) (Ф.И.О.)
Проверил доц. ___________________ /Чиркст Д.Э./
(подпись) (Ф.И.О.)
Санкт-Петербург
2004
ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
Теория была предложена в 1929-1932 гг. X. А. Бете и Дж. Ван Флеком. Ион рассматривается в окружении своих лигандов. Название теории связано с тем, что в ней подход к молекуле аналогичен подходу к кристаллической решетке. Эта теория логически продолжила электростатическую теорию. Все взаимодействия здесь изучаются как ион-ионные или ион-дипольные, но с учетом электронного строения центрального иона, структуры комплекса и взаимодействия различных орбиталей с лигандами.
Возьмем октаэдрический
комплекс, в центре которого находится
ион или атом какого-либо d-элемента,
а в вершинах — анионы или диполи,
обращенные к центру отрицательным
полюсом (рис. 1). Известно, что в свободном
атоме или ионе энергетические уровни
всех пяти d-орбиталей
одинаковы. В октаэдрическом поле лигандов
вырождение снимается. Это связано с
тем, что орбитали
![]() и
и
![]() ,
обозначаемые
,
обозначаемые
![]() ,
вытянуты в направлении лигандов и
благодаря их взаимному отталкиванию
энергия орбиталей становится выше ее
уровня в свободном ионе. Орбитали
,
вытянуты в направлении лигандов и
благодаря их взаимному отталкиванию
энергия орбиталей становится выше ее
уровня в свободном ионе. Орбитали
![]() ,
,![]() и
и
![]() ,
обозначаемые
,
обозначаемые
![]() ,
наоборот, расположены между лигандами
и поэтому обладают меньшей, чем свободный
ион энергией (рис. 2, а).
,
наоборот, расположены между лигандами
и поэтому обладают меньшей, чем свободный
ион энергией (рис. 2, а).
При тетраэдрическом
окружении, наоборот, орбитали
![]() обладают более низкой, а
обладают более низкой, а
![]() —
более высокой энергией, чем в свободном
ионе (рис. 2, б). Расщепление
—
более высокой энергией, чем в свободном
ионе (рис. 2, б). Расщепление

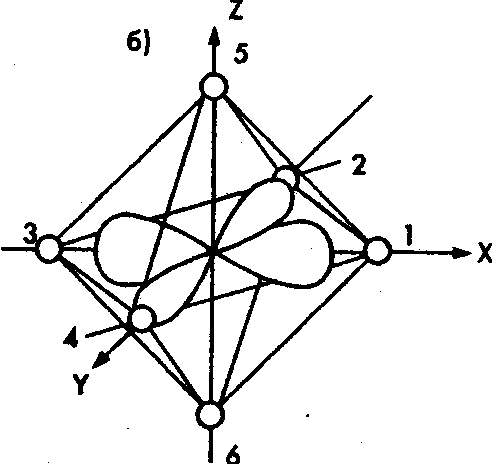
Рис. 1. Орбитали
![]() (а)
и
(а)
и
![]() (б)
в октаэдрическом поле лигандов
(б)
в октаэдрическом поле лигандов
∆ в тетраэдрическом окружении составляет 4/9 ее величины в октаэдрическом поле. Его определяют экспериментально по спектрам поглощения комплексов или рассчитывают теоретически методами квантовой химии.
Расщепление
d-орбиталей
в комплексах хорошо объясняет спектральные
особенности, и в частности, окраску
d-комплексов.
Дело в том, что при неполном заполнении
подуровней
![]() и
и
![]() появляется
возможность перехода электронов с
нижнего уровня на верхний, что
сопровождается поглощением соответствующего
кванта энергии в спектре и изменением
окраски комплекса, если это поглощение
происходит в видимой части спектра.
Если ионы имеют все 10 d-электронов,
такие переходы невозможны. Поэтому ионы
Сu+,
Аg+,
Zn2+,
Сd2+,
Нg2+
с электронной конфигурацией d10
бесцветны. Потеря еще одного электрона
ионом Сu+
и переход его в Сu2+
сопровождается появлением глубокого
синего цвета.
появляется
возможность перехода электронов с
нижнего уровня на верхний, что
сопровождается поглощением соответствующего
кванта энергии в спектре и изменением
окраски комплекса, если это поглощение
происходит в видимой части спектра.
Если ионы имеют все 10 d-электронов,
такие переходы невозможны. Поэтому ионы
Сu+,
Аg+,
Zn2+,
Сd2+,
Нg2+
с электронной конфигурацией d10
бесцветны. Потеря еще одного электрона
ионом Сu+
и переход его в Сu2+
сопровождается появлением глубокого
синего цвета.
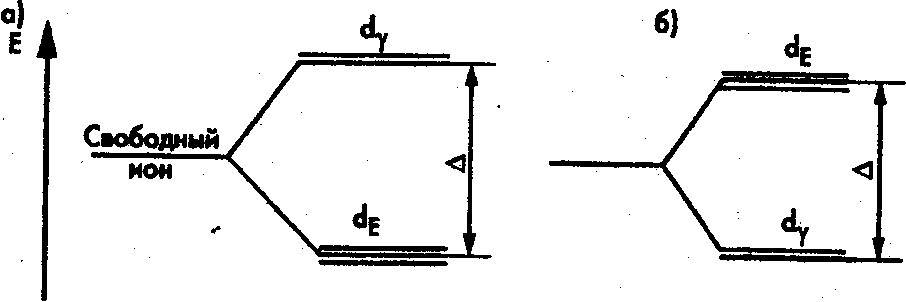
Рис. 2. Расщепление энергетических уровней d-электронов
в октаэдрическом (а) и тетраэдрическом (б) полях лигандов
По величине расщепления ∆ все лиганды располагаются в следующий спектрохимический ряд:
![]() >
>![]() >en>
>en>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]() >
>![]()
Замена лигандов
приводит к изменению цвета закомплексованного
иона. Например, при смене лиганда L
окраска медного комплекса [![]() ]
изменяется от зеленого при L
=
]
изменяется от зеленого при L
=
![]() ,
через голубой при L
= Н2Oк
интенсивно синему при L=NНз,
в точном соответствии со спектрохимическим
рядом.
,
через голубой при L
= Н2Oк
интенсивно синему при L=NНз,
в точном соответствии со спектрохимическим
рядом.
Теория кристаллического
поля смогла объяснить также магнитные
свойства комплексов, которые вызваны
наличием в них неспаренных электронов.
Комплексы, обладающие неспаренными
электронами и, следовательно, магнитным
моментом, называются высокоспиновыми,
а не обладающие магнитными свойствами
— низкоспиновыми. Согласно теории, в
пределах одной группы орбиталей
![]() или
или
![]() электроны располагаются в полном
соответствии с правилом Хунда, сообщая
комплексу максимальный спин. Поэтому
ионы с электронной конфигурацией d1,
d2,
d3
(Sс2+,
Тi2+,
Сr3+)
в октаэдрическом поле — высокоспиновые.
Четвертый электрон (например, в ионах
Сr2+
или Мn4+),
попадая в вон, может заполнить одну из
ячеек нижнего уровня (
электроны располагаются в полном
соответствии с правилом Хунда, сообщая
комплексу максимальный спин. Поэтому
ионы с электронной конфигурацией d1,
d2,
d3
(Sс2+,
Тi2+,
Сr3+)
в октаэдрическом поле — высокоспиновые.
Четвертый электрон (например, в ионах
Сr2+
или Мn4+),
попадая в вон, может заполнить одну из
ячеек нижнего уровня (![]() в октаэдрическом поле) или занять
вакантную ячейку (
в октаэдрическом поле) или занять
вакантную ячейку (![]() )
более высокого уровня. Обе возможности
связаны с затратами энергии. Энергия
«спаривания» электронов и
обычно определяется квантово-химическими
расчетами. Если U
>∆,
электрон предпочитает занять более
высокую орбиталь
)
более высокого уровня. Обе возможности
связаны с затратами энергии. Энергия
«спаривания» электронов и
обычно определяется квантово-химическими
расчетами. Если U
>∆,
электрон предпочитает занять более
высокую орбиталь
![]() и тем самым
увеличить спин комплекса, если U
<∆ ,
электрон вдет на уже занятую электроном
орбиталь и снижает общий спин. Например,
для комплексного иона Fе2+
с конфигурацией d6U=210
кДж/моль, ∆
(Н2O)=124
кДж/моль, ∆
(
и тем самым
увеличить спин комплекса, если U
<∆ ,
электрон вдет на уже занятую электроном
орбиталь и снижает общий спин. Например,
для комплексного иона Fе2+
с конфигурацией d6U=210
кДж/моль, ∆
(Н2O)=124
кДж/моль, ∆
(![]() )
= 397 кДж/моль. Поэтому комплекс [Fе
(Н2O)6]2+
— высокоспиновый, а [Fе(СN)6]4
- -
низкоспиновый. В ионе [Fе
(СN)6]4
- все
электроны находятся на «связывающих»
орбиталях
)
= 397 кДж/моль. Поэтому комплекс [Fе
(Н2O)6]2+
— высокоспиновый, а [Fе(СN)6]4
- -
низкоспиновый. В ионе [Fе
(СN)6]4
- все
электроны находятся на «связывающих»
орбиталях
![]() в отличие от иона [Fе
(Н2O)6]2+
поэтому прочность связи и химическая
устойчивость цианидного иона должна
быть много выше, чем аквоиона, что и
наблюдается на практике.
в отличие от иона [Fе
(Н2O)6]2+
поэтому прочность связи и химическая
устойчивость цианидного иона должна
быть много выше, чем аквоиона, что и
наблюдается на практике.
Отсутствие
электронов на «разрыхляющих» орбиталях
![]() обычно приводит к упрочнению комплекса
или даже к изменению его конфигурации.
В ионе Сu2+,
имеющем конфигурацию d9,
не хватает одного электрона на
«разрыхляющей» орбитали
обычно приводит к упрочнению комплекса
или даже к изменению его конфигурации.
В ионе Сu2+,
имеющем конфигурацию d9,
не хватает одного электрона на
«разрыхляющей» орбитали
![]() что усиливает связь с четырьмя лигандами,
находящимися в плоскости XY.
что усиливает связь с четырьмя лигандами,
находящимися в плоскости XY.
Поэтому для этого иона весьма характерно плоское строение комплексов с КЧ=4 (квадрат с центральным ионом Сu2+).
Таким образом, теория кристаллического поля охватывает гораздо большую совокупность физико-химических свойств, чем электростатическая теория Косселя-Магнуса. Однако и эта теория, также основанная на чисто электростатических представлениях, не позволяет объяснить свойства комплексов металлов с неполярными лигандами, например СО, C6H6, С5H5 и т. д., рассчитать энергии связи, волновые функции и другие параметры химических связей, предсказать структуру комплекса, особенно в случаях, когда КЧ отличается от 4 и 6.
ИПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
-
Дибров И. А.
Неорганическая химия. СПб.: «Лань», 2001. (Учебник для вузов. Специальная литература).
-
Лекции. - Чиркст Д. Э.
Федеральное агентство по образованию
Государственное учреждение профессионального высшего образования
Санкт-Петербургский государственный горный институт им. Г.В. Плеханова
(технический университет)
Кафедра общей и физической химии
РЕФЕРАТ
РАЗЛИЧИЕ ГЕОМЕТРИИ МОЛЕКУЛ ДИОКСИДА
УГЛЕРОДА И ДИОКСИДА СЕРЫ
Выполнил студент гр. ЭП-04 ___________________ /Федотов А.А./
(подпись) (Ф.И.О.)
Проверил доц. ___________________ /Чиркст Д.Э./
(подпись) (Ф.И.О.)
Санкт-Петербург
2004
