- •Г.М.Бутов, с.В. Дьяконов,
- •Введение
- •2. Физико-химические основы процесса получения стирола
- •3. Теоретические основы составления материального баланса, основные показатели химико-технологического процесса
- •4. Теоретические основы составления теплового (энергетического) баланса химико-технологического процесса
- •5. Методика проведения экспериментов и обработка экспериментальных данных
- •5.1. Методика проведения эксперимента
- •5.2. Обработка экспериментальных данных
- •5.3. Определение тепловой нагрузки на реактор и коэффициента полезного действия процесса
- •6. Правила безопасной работы
- •7. Задания
- •8. Контрольные вопросы
- •Исследование кинетики гомогенных химических реакций
- •1. Цели и задачи работы
- •Способы и технология получения сложных эфиров
- •3. Физико-химические основы процесса
- •3.1. Механизм реакции этерификации
- •3.2. Кинетика реакции этерификации
- •3.3. Определение порядка реакции
- •3.4. Расчет термодинамических функций
- •3.5. Составление полного кинетического уравнения реакции
- •4. Экспериментальная часть
- •4.1. Описание лабораторной установки
- •4.2. Методика проведения эксперимента
- •Внимание! секундомер и воздуходувку не выключать
- •4.3. Обработка экспериментальных данных
- •Данные для расчёта общего порядка реакции
- •5. Правила безопасной работы
- •6. Контрольные вопросы
- •2. Теоретическая часть
- •2.1. Химическое равновесие
- •2.1.1. Зависимость константы равновесия от температуры
- •2.1.2. Экспериментальное определение равновесного состава реакционной массы и константы равновесия
- •3.Методика проведения эксперимента и обработка экспериментальных данных
- •3.1. Методика проведения эксперимента
- •3.2. Этерефикация уксусной кислоты этиловым или изопропиловым спиртом
- •3.2.1 Обработка результатов эксперимента
- •4. Задание
- •5. Правила безопасной работы
- •6. Контрольные вопросы
- •Исследование кинетики реакции металлов с кислотами
- •Цели и задачи работы
- •2. Теоретическая часть
- •3. Методика проведения эксперимента
- •Внимание: показание секундомера не обнуляют.
- •4. Обработка экспериментальных данных
- •4.1. Определение лимитирующей стадии процесса
- •5. Задание
- •6. Контрольные вопросы
- •Библиографический список
- •Лабораторный практикум по общей химической технологии
- •400005, Г. Волгоград, пр. Им. В. И. Ленина, 28. Корп. 1
3.3. Определение порядка реакции
Для того чтобы определить общий порядок реакции, надо взять реагенты в стехиометрическом отношении. Для определения частного порядка по реагенту А второй реагент В берется в таком избытке, чтобы изменением его концентрации в ходе опыта можно было пренебречь. При этом общий порядок и порядок реакции по данному реагенту можно рассчитать по зависимости начальной скорости от начальной концентрации реагента А, или метод, основанный на зависимости, изменяющейся во времени скорости реакции от текущей концентрации реагента А.
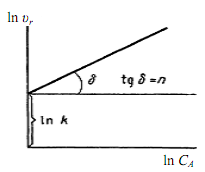
1. При использовании первого метода – проводят при постоянной температуре серию опытов с различными исходными концентрациями реагентов и построив логарифмическую анаморфозу
ln υr,0 = ln k + n · ln СA,0 (3.9)
по наклону прямой находят порядок реакции.
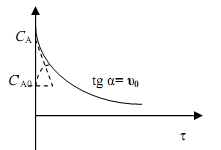
2. При применении второго метода – для нахождения порядка реакции определяют в различные моменты времени скорость реакции и концентрацию реагента А (рис.3.4), и, построив логарифмическую анаморфозу в соответствии с уравнением 13
ln υr = ln k + n · ln СA , (3.10)
по наклону прямой находят порядок реакции.
|
САО
СА
|
|
|
Рис.3.4. Определение начальной скорости и порядка реакции при переменных начальных концентрациях реагента А.
| |
3.4. Расчет термодинамических функций
Термодинамика реакций не зависит от механизма, имеет значение лишь степень превращения веществ. Термодинамические величины, обычно, вычисляются на основании измерений температурной зависимости скорости реакции по уравнению Аррениуса:
![]() (3.11)
(3.11)
где k – константа скорости реакции при температуре Т;
EA – энергия активации;
А – частотный фактор Аррениуса, характеризует вероятность того, что при столкновении молекул исходных веществ произойдет разрыв старых и образование новых связей;
R – газовая постоянная.
Если известны три и более константы скорости реакции, определенные при различных температурах, можно рассчитать энергию активации переходного состояния и частотный фактор Аррениуса.
Для этого удобно пользоваться графическим методом (рис.3.5), вытекающим из логарифмической формы уравнения Аррениуса:
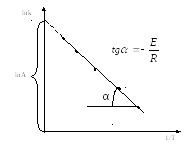 lnk
= lnA
– EA
/RT
lnk
= lnA
– EA
/RT
|
|
Рис.3.5. Определение энергии активации по экспериментальным данным |
Определив энергию активации (EA) и вычислив частотный фактор Аррениуса (А), рассчитывают термодинамические характеристики реакции в стандартных условиях:
ΔHoT – энтальпия активации или тепловой эффект реакции:
∆Ho= EoA – RT (3.12)
она, обычно, равна или близка к разности ΔЕ внутренних энергий исходных и конечных веществ;
ΔSoT – энтропия активации, энтропия является термодинамической мерой статистической вероятности системы; ее можно рассчитать по уравнению:
ΔSoT=4,576 lg (A/T) – 49,21 (3.13)
ΔGoT – изобарно-изотермический потенциал или энергия Гиббса, характеризует вероятность протекания реакции:
ΔG˚ = ΔH˚ – T · ΔS˚ (3.14)