
- •Г.М.Бутов, с.В. Дьяконов,
- •Введение
- •2. Физико-химические основы процесса получения стирола
- •3. Теоретические основы составления материального баланса, основные показатели химико-технологического процесса
- •4. Теоретические основы составления теплового (энергетического) баланса химико-технологического процесса
- •5. Методика проведения экспериментов и обработка экспериментальных данных
- •5.1. Методика проведения эксперимента
- •5.2. Обработка экспериментальных данных
- •5.3. Определение тепловой нагрузки на реактор и коэффициента полезного действия процесса
- •6. Правила безопасной работы
- •7. Задания
- •8. Контрольные вопросы
- •Исследование кинетики гомогенных химических реакций
- •1. Цели и задачи работы
- •Способы и технология получения сложных эфиров
- •3. Физико-химические основы процесса
- •3.1. Механизм реакции этерификации
- •3.2. Кинетика реакции этерификации
- •3.3. Определение порядка реакции
- •3.4. Расчет термодинамических функций
- •3.5. Составление полного кинетического уравнения реакции
- •4. Экспериментальная часть
- •4.1. Описание лабораторной установки
- •4.2. Методика проведения эксперимента
- •Внимание! секундомер и воздуходувку не выключать
- •4.3. Обработка экспериментальных данных
- •Данные для расчёта общего порядка реакции
- •5. Правила безопасной работы
- •6. Контрольные вопросы
- •2. Теоретическая часть
- •2.1. Химическое равновесие
- •2.1.1. Зависимость константы равновесия от температуры
- •2.1.2. Экспериментальное определение равновесного состава реакционной массы и константы равновесия
- •3.Методика проведения эксперимента и обработка экспериментальных данных
- •3.1. Методика проведения эксперимента
- •3.2. Этерефикация уксусной кислоты этиловым или изопропиловым спиртом
- •3.2.1 Обработка результатов эксперимента
- •4. Задание
- •5. Правила безопасной работы
- •6. Контрольные вопросы
- •Исследование кинетики реакции металлов с кислотами
- •Цели и задачи работы
- •2. Теоретическая часть
- •3. Методика проведения эксперимента
- •Внимание: показание секундомера не обнуляют.
- •4. Обработка экспериментальных данных
- •4.1. Определение лимитирующей стадии процесса
- •5. Задание
- •6. Контрольные вопросы
- •Библиографический список
- •Лабораторный практикум по общей химической технологии
- •400005, Г. Волгоград, пр. Им. В. И. Ленина, 28. Корп. 1
5.3. Определение тепловой нагрузки на реактор и коэффициента полезного действия процесса
Коэффициент полезного действия использования тепловой энергии рассчитывают по формуле:
![]() (5.3)
(5.3)
где QF - тепловая нагрузка на реактор рассчитывают по уравнениям, приведенным в разделе 4, по формулам 4.3 –4.18, т.е. определяют количество тепла, которое необходимо подвести или отвести от реактора для поддержания заданной температуры. Результаты расчета сводят таблицу теплового баланса.
![]() –
тепло, практически затрачиваемое на
проведение процесса. Его определяют с
помощью счетчика киловатт-часов. Измеряют
количество израсходованных кВт-час
электроэнергии за время эксперимента
и рассчитывают по формуле
–
тепло, практически затрачиваемое на
проведение процесса. Его определяют с
помощью счетчика киловатт-часов. Измеряют
количество израсходованных кВт-час
электроэнергии за время эксперимента
и рассчитывают по формуле
![]() (5.4)
(5.4)
где N1 – показания счетчика кВт-часов до эксперимента;
N2 - показания счетчика кВт-часов после проведения эксперимента. Данные измерений и результаты расчетов заносят в таблицу 5.3.
Таблица 5.3
Результаты расчета тепловой нагрузки на реактор и КПД процесса
|
Температура реакции, оС |
Показания счетчика |
QF практическое |
QF
|
η, %
| |
|
N1 до опыта кВт-час |
N2 после опыта, кВт-час | ||||
|
550 |
|
|
|
|
|
|
600 |
|
|
|
|
|
|
650 |
|
|
|
|
|
|
700 |
|
|
|
|
|
6. Правила безопасной работы
Перед началом эксперимента включить вытяжной шкаф.
Проверить с преподавателем правильность собранной установки и ее герметичность.
Загрузку реагента производить в вытяжном шкафу при включенной вентиляции.
Во время выполнения лабораторной работы пользоваться защитными очками.
Вблизи лабораторной установки категорически запрещается держать открытое пламя огня.
7. Задания
На основе полученных экспериментальных данных составить материальный баланс процесса при различных температурах 550, 600, 650, 700 оС.
Определить выход целевого продукта, степень превращения этилбензола и селективность процесса для данных температур и построить графики:
С
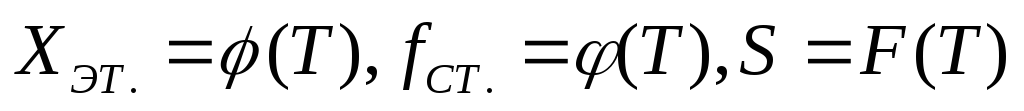 оставить
энергетический баланс процесса
дегидрирования этилбензола и определить
выход.
оставить
энергетический баланс процесса
дегидрирования этилбензола и определить
выход.Обосновать оптимальные условия функционирования ХТС.
Представить схему реакционного узла дегидрирования этилбензола.
8. Контрольные вопросы
Ход работы и порядок расчетов.
Синтез и технология получения стирола, альфа – метилстирола. Схема химического производства.
Теоретические основы составления материальных и энергетических балансов.
Расчет тепловых эффектов химических процессов.
Технико – экономические показатели ХТС: степень превращения, селективность реакции, выход продукта (для необратимых, обратимых, параллельных и последовательных реакций), практические расходные коэффициенты.
Лабораторная работа № 2
Исследование кинетики гомогенных химических реакций
1. Цели и задачи работы
Цель работы: Экспериментальное изучение закономерностей реакции хлорангидрида бензойной кислоты с гептиловым спиртом с образованием сложного эфира, составление кинетического уравнения процесса.
Задачи:
– Знакомство с экспериментальными методами исследования кинетики гомогенных каталитических реакций.
– Изучение методов расчета кинетических и активационных параметров реакции по полученным экспериментальным данным и составление полного кинетического уравнения.
Знания: Студент должен знать теоретические основы изучаемого процесса, влияние технологических параметров на его интенсивность.
Умения: На основе полученных экспериментальных данных провести расчеты скорости и порядка реакции, составить полное кинетическое уравнение реакции.
