
- •Г.М.Бутов, с.В. Дьяконов,
- •Введение
- •2. Физико-химические основы процесса получения стирола
- •3. Теоретические основы составления материального баланса, основные показатели химико-технологического процесса
- •4. Теоретические основы составления теплового (энергетического) баланса химико-технологического процесса
- •5. Методика проведения экспериментов и обработка экспериментальных данных
- •5.1. Методика проведения эксперимента
- •5.2. Обработка экспериментальных данных
- •5.3. Определение тепловой нагрузки на реактор и коэффициента полезного действия процесса
- •6. Правила безопасной работы
- •7. Задания
- •8. Контрольные вопросы
- •Исследование кинетики гомогенных химических реакций
- •1. Цели и задачи работы
- •Способы и технология получения сложных эфиров
- •3. Физико-химические основы процесса
- •3.1. Механизм реакции этерификации
- •3.2. Кинетика реакции этерификации
- •3.3. Определение порядка реакции
- •3.4. Расчет термодинамических функций
- •3.5. Составление полного кинетического уравнения реакции
- •4. Экспериментальная часть
- •4.1. Описание лабораторной установки
- •4.2. Методика проведения эксперимента
- •Внимание! секундомер и воздуходувку не выключать
- •4.3. Обработка экспериментальных данных
- •Данные для расчёта общего порядка реакции
- •5. Правила безопасной работы
- •6. Контрольные вопросы
- •2. Теоретическая часть
- •2.1. Химическое равновесие
- •2.1.1. Зависимость константы равновесия от температуры
- •2.1.2. Экспериментальное определение равновесного состава реакционной массы и константы равновесия
- •3.Методика проведения эксперимента и обработка экспериментальных данных
- •3.1. Методика проведения эксперимента
- •3.2. Этерефикация уксусной кислоты этиловым или изопропиловым спиртом
- •3.2.1 Обработка результатов эксперимента
- •4. Задание
- •5. Правила безопасной работы
- •6. Контрольные вопросы
- •Исследование кинетики реакции металлов с кислотами
- •Цели и задачи работы
- •2. Теоретическая часть
- •3. Методика проведения эксперимента
- •Внимание: показание секундомера не обнуляют.
- •4. Обработка экспериментальных данных
- •4.1. Определение лимитирующей стадии процесса
- •5. Задание
- •6. Контрольные вопросы
- •Библиографический список
- •Лабораторный практикум по общей химической технологии
- •400005, Г. Волгоград, пр. Им. В. И. Ленина, 28. Корп. 1
2.1.1. Зависимость константы равновесия от температуры
Так как в соответствии с уравнением Менделеева-Клапейрона
P=CRT, тоKp =KC (RT)n , (2.8)
где
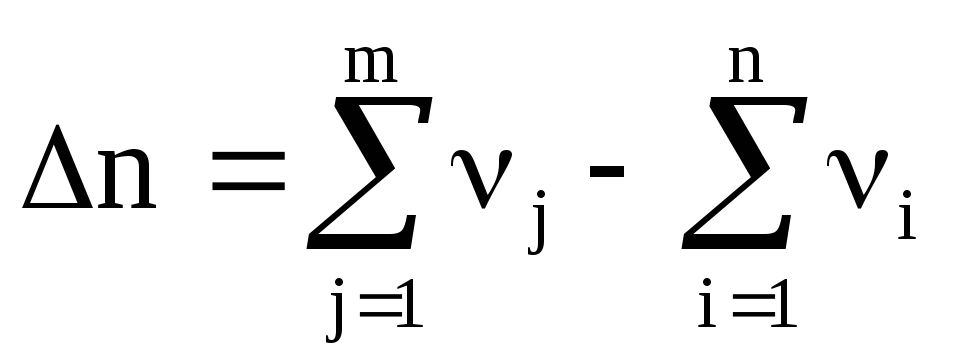 – изменение числа молей газообразных
реагентов в результате реакции.
– изменение числа молей газообразных
реагентов в результате реакции.
Функциональная зависимость константы равновесия от температуры при постоянном давлении передается уравнением изобары Вант-Гоффа
![]() (2.9)
(2.9)
где
![]() – теплота химической реакции; Т –
температура процесса;R– газовая постоянная.
– теплота химической реакции; Т –
температура процесса;R– газовая постоянная.
Из уравнения (2.9)
следует, что при положительных значениях
![]() (эндотермические реакции)dlnKP/dT> 0 и КР(Т) – возрастающая функция.
Если
(эндотермические реакции)dlnKP/dT> 0 и КР(Т) – возрастающая функция.
Если![]() < 0 (экзотермические реакции), тоdlnKP/dT< 0 и константа равновесия уменьшается
с повышением температуры.
< 0 (экзотермические реакции), тоdlnKP/dT< 0 и константа равновесия уменьшается
с повышением температуры.
Для процессов, протекающих при постоянном объеме, зависимость константы равновесия от температуры передается уравнением изохоры Вант - Гоффа
![]() (2.10)
(2.10)
где U– изменение внутренней энергии химической реакции.
Уравнения изобары и изохоры реакции определяют зависимость константы равновесия от температуры в дифференциальной форме.
При теоретическом исследовании сложных и простых обратимых химических процессов, возникает необходимость, прежде всего, установить, какие реакции из нескольких возможных или обратимых термодинамически более вероятны.
Мерой сродства
реагентов к химическому взаимодействию
в изобарно-изотермических условиях
служит энергия Гиббса
![]()
![]() ,
которую рассчитывают, либо определяют
на основе экспериментальных данных по
уравнению:
,
которую рассчитывают, либо определяют
на основе экспериментальных данных по
уравнению:
![]() (2.11)
(2.11)
Для расчета
![]() в стандартных условиях используют
уравнение:
в стандартных условиях используют
уравнение:
![]() (2.12)
(2.12)
где![]()
![]() - энергия Гиббса веществ, участвующих
в химической реакции при стандартной
температуре;
- энергия Гиббса веществ, участвующих
в химической реакции при стандартной
температуре;
![]() -
стехиометрические коэффициенты в
уравнении реакции для продуктов реакции
и исходных реагентов соответственно;
-
стехиометрические коэффициенты в
уравнении реакции для продуктов реакции
и исходных реагентов соответственно;
![]() -
тепловой эффект реакции при данной
температуре;
-
тепловой эффект реакции при данной
температуре;
![]() - изменение энтропии
реакции при данной температуре;
Т-температура реакции.
- изменение энтропии
реакции при данной температуре;
Т-температура реакции.
Тепловой эффект при температуре химической реакции рассчитывают по уравнению:
![]() ,
(2.13)
,
(2.13)
где
![]() - тепловой эффект химической реакции
при температуре 298 К,а,
b,
c,
- разности коэффициентов. Значения этих
величин определяют по следствию из
закона Гесса, используя справочные
данные.
- тепловой эффект химической реакции
при температуре 298 К,а,
b,
c,
- разности коэффициентов. Значения этих
величин определяют по следствию из
закона Гесса, используя справочные
данные.
![]() (2.14)
(2.14)
![]() .
(2.15)
.
(2.15)
![]() (2.16)
(2.16)
![]() (2.17)
(2.17)
Изменение энтропии реакции при данной температуре можно рассчитать по уравнению:
![]() (2.18)
(2.18)
Стандартное
значение
![]() находят по разности между энтропией
конечных продуктов и исходных веществ.
находят по разности между энтропией
конечных продуктов и исходных веществ.
![]()
![]() ,
(2.19)
,
(2.19)
где
![]() -
энтропия химических веществ участников
реакции при стандартной температуре;
-
энтропия химических веществ участников
реакции при стандартной температуре;
Термодинамическая
вероятность протекания химических
реакций определяется величиной и знаком
энергии Гиббса. При
![]() < 0 наиболее вероятное течение прямой
реакции (справа налево); при
< 0 наиболее вероятное течение прямой
реакции (справа налево); при
![]() > 0 наиболее вероятное течение обратной
реакции (слева направо); при
> 0 наиболее вероятное течение обратной
реакции (слева направо); при
![]()
0 существует равновесие реакции.
0 существует равновесие реакции.
Таким образом, рассчитав величину энергии Гиббса для всех реакций, которые теоретически возможны в рассматриваемом сложном и (или) обратимом процессе и сравнивая их, можно установить термодинамически наиболее вероятную реакцию. Если этой реакцией является целевая реакция, то остается подобрать такие параметры технологического режима, которые будут обеспечивать наивысшую степень превращения сырья (наибольший выход продукта). Подбор параметров для обратимых реакций можно проводить при известном значении константы равновесия.
Для расчета константы равновесия в изобарно-изотермических условиях используют уравнение изотермы Вант-Гоффа:
![]()
![]() ,
,
![]() ,
(2.20)
,
(2.20)
где Кр - константа равновесия, R-универсальная газовая постоянная.
Если рассчитанное значение Кр << 1, то равновесие в системе смещено в сторону образования исходных реагентов (выход продукта мал). При Кр>>1, равновесие в системе смещено в сторону образования продуктов реакции (выход продукта велик). Если Кр 1, то система находится в состоянии равновесия.
В изохорно -
изотермических процессах этот же анализ
проводят на основе энергии Гельмгольца
![]() .
.
