
Shpargalka_po_biohimii(ceccuu.net) / T16
.doc16
•Представление о строении и функциях углеводной части гликолипидов и гликопротеидов. Гликозилирование белков. Примеры гликолипидов и гликопротеидов (группы крови, гликозилирование мембранных белков).
С троение
и ф-ии гликолипидов(ГЛ).
ГЛ хорошо представлены в нервной ткани
(в мозгах) + на наружной поверх-ти плазм-ой
мемб-ны, где они входят в число др.
углеводов клеточной поверх-ти. Главная
форма ГЛ явл-ся гликосфинголипиды. Они
содержат церамид + 1 или несколько
остатков сахаров. 2 простейших соед-ия
в этой группе: галактозилцерамид (гал-д)
и глюкозилцерамид (глюк-д). Гал-д –
главный гликосфинголипид головного
мозга и нервных тканей. В его состав
входят различные С24
– жк-ты. Он может превращ-ся в
сульфагалактоззилцерамид (сульфатид),
кот-ый входит в состав миелина. Из глюк-да
образ-ся ганглиозиды – это гликосфинголипиды
+ 1 или несколько мол. сиаловой к-ты
(нейраминовая к-та NeuAc).
Они выполняют рецепторные ф-ции в нервной
ткани. Простейшим ганглиозидом явл.Gm3.
Он содержит церамид + 1 мол. галактозы +
1 мол. нейраминовой к-ты. G
– означ. ганглиозид, м- 1 мол. сиаловой
к-ты, 3- условный номер, присвоенный на
основе положения при хроматографическом
разделении. Gm1
– входит в состав эпителия кишечника
,явл. рецептором холерного токсина.
троение
и ф-ии гликолипидов(ГЛ).
ГЛ хорошо представлены в нервной ткани
(в мозгах) + на наружной поверх-ти плазм-ой
мемб-ны, где они входят в число др.
углеводов клеточной поверх-ти. Главная
форма ГЛ явл-ся гликосфинголипиды. Они
содержат церамид + 1 или несколько
остатков сахаров. 2 простейших соед-ия
в этой группе: галактозилцерамид (гал-д)
и глюкозилцерамид (глюк-д). Гал-д –
главный гликосфинголипид головного
мозга и нервных тканей. В его состав
входят различные С24
– жк-ты. Он может превращ-ся в
сульфагалактоззилцерамид (сульфатид),
кот-ый входит в состав миелина. Из глюк-да
образ-ся ганглиозиды – это гликосфинголипиды
+ 1 или несколько мол. сиаловой к-ты
(нейраминовая к-та NeuAc).
Они выполняют рецепторные ф-ции в нервной
ткани. Простейшим ганглиозидом явл.Gm3.
Он содержит церамид + 1 мол. галактозы +
1 мол. нейраминовой к-ты. G
– означ. ганглиозид, м- 1 мол. сиаловой
к-ты, 3- условный номер, присвоенный на
основе положения при хроматографическом
разделении. Gm1
– входит в состав эпителия кишечника
,явл. рецептором холерного токсина.
Строение и ф-ии гликопротеинов. Гликопротеины – это белки, содержащие олигосахаридные (гликановые) цепи, ковалентно присоед-ые к полипептидной основе. В составе олигосахаридных цепей гликопротеинов присутствует около 12 моносахаридов. На концах олигосахаридных цепей – N-ацетилнейраминовая к-та, присоед-ая к претерминаьным остаткам галактозы (Gal) или N-ацетилгалактозамина (GalNAc). Др. сахара занимают положение ближе к середине цепи.
Гликопротеины дел-ся на 4 группы в зависимости от природы связей между полипеп-ыми и олигосах-ыми цепями: 1)содержащие связь Ser (или Thr)-GalNAc;Рисунок 54.1 на странице 303, Мари том 2. 2)связь Ser-Xyl; 3) связь гидроксилизин (Hyl)-Gal; 4) связь Asn-GlcNAc. Гликопротеины классов 1,2,3 соед-ся с соответствующими АК-тами О-гликозидной связью (т.е. связью ОН бок.цепи АК-ты и остатком сахара). Класс 4 – N-гликозидная связь (т.е. связь N-амидной группой аспарагина и остатком сахара). Рисунок 54.4 на стр. 305 (ТОМ2)
Гликозилирование белков (гликопртеинов). «Процессинг олигосахаридов» разделен на 2 этапа: 1) сборка и перенос олигосахарид-пирофосфорил-долихола; 2)процессинг олисахаридной цепи.
-
Долихол – явл. самым длинным из природных углеводородов, построенных из одинаковых повторяющихся компонентов(17-20 компонентов). Сначала долихол фосфорилируется под действием долихолкиназой при использ. АТР в кач-ве донора фосфата→долихолфосфат (Dol-P). GlcNAc-пирофосфорил -долихол (GlcNAc-P – P-Dol) явл. ключевым липидом, действующий в кач-ве акцептора других сахаров при сборке олигосахарид-пирофосфорил-долихола. →а) 2-ой остаток GlcNAc присоед. К 1-ому; донор – UDPGlcNAc; б) присоед-ся 5 остатков Man с использованием в кач-ве донора GDP-маннозы; в)присоед. 4 допол-ых остатка Man, при этом донор – P-man; г) образ-ся 3 перифер-их остатка глюкозы, донор Dol-P-Glc.
-
Прцессинг олисах-ной цепи : ранняя стадия→поздняя стадия.
•Начальные стадии синтеза холестерина. Роль холестерина и его эфиров в построении биологических мембран Регуляция синтеза и активности ГМГ-редуктазы. Синтез желчных кислот из холестерина. Конъюгация желчных кислот, первичные и вторичные желчные кислоты. Выведение желчных кислот и холестерина из организма.
Холестерол – амфипатический липид, структурн.компонент мембран и нар.слоя липопротеинов плазмы крови (транспортир-ся ими).
Сказано «начальные стадии синтеза», поэтому вставляю кратенькую схемку [St1]
Б иосинтез
– в микросомах (ЭПР) и цитозоле. Источник
– ацетил-СоА. Итак: ацетил-СоА мевалонат
(6 С-атомов) ощепление
СО2
изопреноидная
единица 6
единиц конденсируются сквален
циклизация
ланостерол
(стероид) холестерол.
иосинтез
– в микросомах (ЭПР) и цитозоле. Источник
– ацетил-СоА. Итак: ацетил-СоА мевалонат
(6 С-атомов) ощепление
СО2
изопреноидная
единица 6
единиц конденсируются сквален
циклизация
ланостерол
(стероид) холестерол.
Промежуточные продукты связываются с сквален- и стеролпереносящими белками.
Регуляция синтеза. Синтез ингиб-ся самим холестеролом (отр.обр.часть) и ЛПНП, глюкагоном и глюкокортикоидами, усил-ся инсулином.
Регуляция – в основном, за счет ГМГ-СоА-редуктазы.
Голодание ↓синтеза холестерола.
Выводится – около 1 г холестерола в день – половина – в виде желч.кислот, другая половина – в виде нейтральных стероидов.
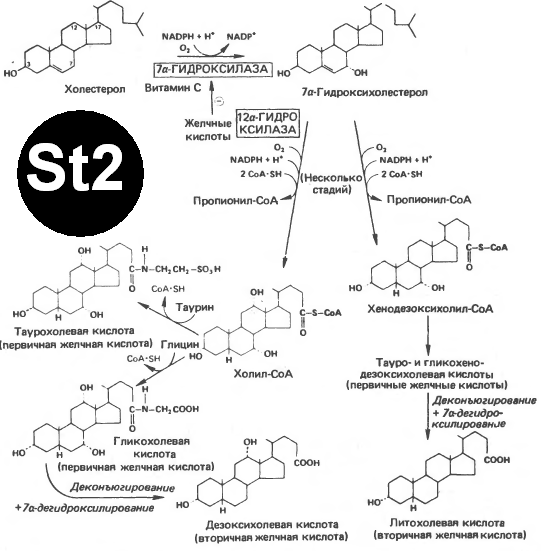
Синтез желчных кислот. [St2]
Первичные желч.к-ты – синтез в печени из холестерола. В основном – холевая и хенодезоксихолевая кислоты. Далее –образование эфиров с СоА (под действием микросомального фермента печени) коньюгация с глицином и таурином (с глицином – в 3 раза больше) в желчь.
В кишечнике – под действием киш.бактерий – деконьюгирование и 7α-гидроксилирование втор.желч.к-ты (из холевой – дезоксихолевая, из хенодезоксихолевой – литохолевая).
•Строение тРНК. Активация аминокислот.
3.тРНК-небол одноцепоч мол.тРНК бактер и внутримитохонд-го цитозоля эукариот сост из 73-93нуклеот.Кажд ам.к-те соответст хотя бы одна тРНК.Чтобы распозн все аминокислотн кодоны, тебует не мен 32тРНК.Многие тРНК выделены в гомогенном виде.Описали нуклеот послед аланиновой тРНК дрожжей.(ее первую полн секвентировали,содерж 76нуклеот остат, в том чис10модифицирован.Во всех тРНК 8 или бол нуклеот содерж модифициров ос-ия, мног з кот представ метилированные производ главных осн.На5’конц наход остат гуанилов к-ты(pG), а на3’ присуств тринуклеотидная последов –С-С-А (3’).Если изобраз стр-ую форм тРНК в виде,чтобы число внутримолек комплементран пар было максим –вид»клеверного листа».В нем различ 4 ветви(иногда дополн5ветвь).»из этих ветв участв в фун-ии тРНК в качестве адаптора.Акцепторн ветвь присоед спец ам.к-ту(АК),карбоксил гр кот эфирн cd прикрепл к2’- или3’-гидроксил гр 3эконцевого остат А в тРНК.Антикодоновая ветвь содер антикодон,т.е.спец триплет нуклеотид,кот комплементарен в антипарал-ом направл соответст триплету(кодону)мРНК и мож образ с ним пары основан.Кажд тРНК им антикодон.Две ее др ветви-дигидроуридиловая ветвь,кот содерж необычн нуклеозид дигидроуридин, и ТΨС-ветвь(наход нуклеозид риботимидин(Т),как правило,не присутств в РНК, и нуклеозид псевдоуридин(Ψ), в кот основ и пеноза соед необычн углерод-углеродной св.На 1-ом этапе босинт белка,протек в цитозоле кл,20различ ам.к-т присое эфирной св к соотв-им тРНК.Эти проц кат-ся20различн активир-ми ферм,назыв аминоацил-тРНК-синтетазами,кажд из кот спец по отнош к какой-то одной ам.к-те и к соответств тРНК.Процесс активации ам.к.сост из 2-х стад,осущ-ы в каталитич центре ферманта.1-ая:в актив цент в резул взаимод АТР и ам.к-ты обр-ся вязанное с фермент проме-ое соед-аминоациладенилат.Карбоксил гр аминокисл соед ангидридн связ-ю с5’фосфат гр АМР,вытес при этом пирофосфат.2-ая:аминоацильн остаток перенос с аминоациладенилата,связан с фермен,на соответ спец тРНК:на последн сад аминоацил оста связыв со свободн2’-или3’гидроксил гр концев остатА в мол тРНК,но присоед к одной из них,он мож свобод перепрыг на др гидроксил гр и обратно.Эфирн св м/ду ам.к. и тРНК явл высокоэнергетич.Образ-ся в проц активац неорган пирофосфат гидролиз-ся пирофосфатазой до ортофосфата.На актив кажд ам.к. затрачив 2высокоэнергет фосфатн св,что деоает сумманую р-цию акт-ции ам.к.практич.необрат.
