
Shpargalka_po_biohimii(ceccuu.net) / T22
.doc
Б ИЛЕТ
22
ИЛЕТ
22
•Липопротеиды крови человека. Роль аполипопротеинов в составе липопротеидов различной плотности. Липопротеинлипаза.
Классификация липопротеидов: •хиломикроны; •ЛПОНП; •ЛПНП; •ЛПВП
Структура липопротеидов: •апобелок (белковая часть – нее приходится от 1%(хиломикроны) до 60% ЛПВП); •липидное ядро (неполярные триациглицеролы и эфиры холестерола); •наружный слой (фосфолипиды, холестерол, апобелки) Функции апобелков: •Способствуют формированию мицелл ЛП в эндоплазматическом ретикулуме гепатоцитов; •Служат лигандами для специфических рецепторов на поверхности плазматической мембраны клеток; •Кофакторы (активаторы и ингибиторы) процессов липолиза и метаболизма ЛП в сосудистом русле
Классы апобелков (Содержание апобелков в липопротеидах:) •в ЛПВП - АI и АII; •в ЛПНП – В100; •в ЛПОНП – В100, Е; •в хиломикронах – В48; •Апобелки CI, CII, CIII содержатся во всех
Методы разделения: •Ультрацентрифугирование (основан на разделении по различной различной плотности) – не пригоден для широкого практического использования; •Электрофорез
Хиломикроны -Образуются из пищевых жиров (триглицеридов, холестерина) в энтероцитах Функции: •Основная транспортная форма экзогенных (пищевых) жиров; •Доставляют в печень жирорастворимые витамины
ЛПОНП: -Синтезируются в печени из триглицеридов; -В составе имеют только апоВ-100. В кровотоке в их состав включаются апоС-II, апоЕ. Функции:-Являются основной транспортной формой эндогенных триглицеридов
Л ПНП:
-ЛПНП образуются
из ЛПОНП через образование ЛППП (некоторая
часть синтезируется в печени); -Концентрация
ЛПНП увеличивается в детском возрасте
и достигает соответствующего уровня,
как у взрослого во время после полового
созревания; Функции:
-Главный
переносчики холестерина в эфирной форме
ПНП:
-ЛПНП образуются
из ЛПОНП через образование ЛППП (некоторая
часть синтезируется в печени); -Концентрация
ЛПНП увеличивается в детском возрасте
и достигает соответствующего уровня,
как у взрослого во время после полового
созревания; Функции:
-Главный
переносчики холестерина в эфирной форме
ЛПВП: -Синтезируется в печени и кишечнике; Функции: -Являются хранилищем апобелков С и Е, которые используются для метаболизма хиломикронов и ЛПОНП; -Опосредуют обратный транспорт холестерина
Особенности ЛПВП: Холестерин, синтезированный в печени, переносится в ткани в составе ЛПНП; Поступающие с пищей триглицериды переносятся в составе ХМ в ткани; Эндогенные триглицериды, синтезируемые в печени, транспортируются в виде ЛПОН; Получают холестерин из периферических клеток и других липопротеинов
•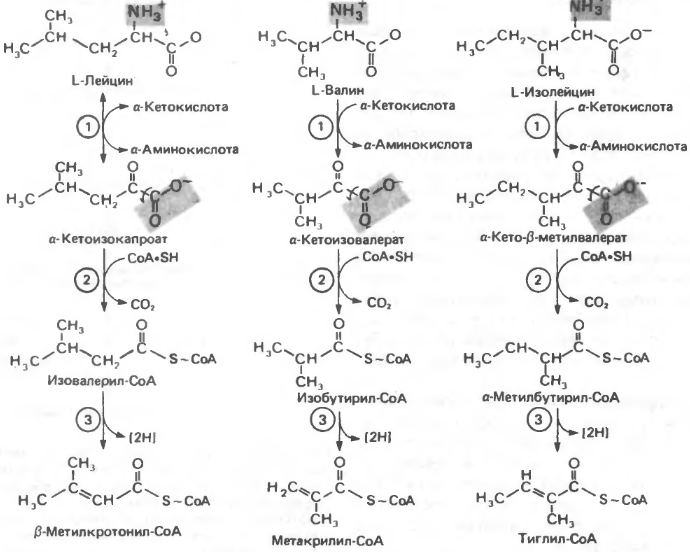 Превращения
алифатических аминокислот. Сопоставление
превращения алифатических аминокислот
с окислением жирных кислот. Обмен
фенилаланина и тирозина. Наследственные
болезни, связанные с нарушениями обмена
фенилаланина и тирозина
Превращения
алифатических аминокислот. Сопоставление
превращения алифатических аминокислот
с окислением жирных кислот. Обмен
фенилаланина и тирозина. Наследственные
болезни, связанные с нарушениями обмена
фенилаланина и тирозина
История: исследовали взаимопревращения в-в. Открыли: Ile, Lys, Phe, Tyr, Trp превращ-ся и в гликоген, и в жир; Leu – только в жир; Остальные АК – только в гликоген.
Суть анаболизма АК: сначала – отщепление азота (чаще всего переаминированием) амфиболич.интермедиаты (окисл.углеводороды).
IV.Аминок-ты, образующие ацетил-КоА [AA4] (т.е.без промежуточного обр-ия пирувата). Тирозин. Патологии: Тирозинемия типа I (тирозиноз; сложн.патогенез, накопление ингибиторов ферментов катаболизма Tyr), Тирозинемия типа II (синдром Рихнера-Ханхарта; недостат-ть тирозин-трансаминаз печени), Тирозинемия новорожденных (дефект n-гидроксифенил-пируват-гидроксилазы), Алкаптонурия (дефект гомогентизат-оксидазы выведение субстрата с мочой темно-коричн.цвет мочи). Фенилаланин: Тирозин (фенилаланин-гидроксилаза). Патологии: Фенилкетонурия (дефект Phe-гидроксилазы появление альт.продуктов метаболизма Phe). Лизин (!Азот удаляется не переаминированием, а конденсацией с α-КГ и послед.дегидрогенированием и расщеплением продукта). Триптофан. Патология – б-нь Хартнупа.
V.Аминок-ты, образующие сукцинил-КоА. [AA5] Метионин. !NB: взаим-ет с АТР S-аденозилметионин дальн.катаболизм ИЛИ !перенос активированной S-метильной группы на др.соед-ия (холин, креатин, адреналин, нуклеотиды и др.). Лейцин, Валин, Изолейцин. [AA6] Патологии: Гипервалинемия (наруш.переаминирования валина), б-нь «кленового сиропа» (кетонурия разветвленных кетокислот, дефект декарбоксилазы α-кислот; характ.запах мочи: «жженый сахар»), изовалериановая ацидемия (дефект изовалерил-СоА-дегидрогеназы накопление изовалерил-СоА гидролиз до изовалерата и его накопление).

•Регуляция трансляции.
Билет 22, вопрос 3.
Трансляция. Трансляция – мРНК зависимый синтез белка. Синтез белка (трансляция) зависит от координированного взаимодействия более ем 100 маккромолекул, к кот-ым относятся рибосомы, мРНК, тРНК, активирующие ферменты и белковые факторы. Синтез начин-ся с активации АК-от аминоацил – тРНК – синтетазами (активирующими ферментами) за счет АТР. Синтетазы соед-ют карбокс-ую группу АК-ТЫ с 2- и 3-гидроксильной группой остатка аденозина на 3-конце тРНК. Для каждой АК-ты имеется минимум 1 активирующий фермент + для каждой ак-ты есть специф-ая тРНК.
Синтез белка происходит в 3 этапа: инициация, элонгация, терминация.Инициация – информ-ая РНК, фермилметионил – тРНКf и 30S-субчастица рибосомы соед-ся =>30S – комплекс инициации. Сигнал начала трансляции – кодон AUG (или GUG). Затем 50S-субчастица рибосомы присоед-ся к комплексу =>образ-ся 70S-комплекс инициации. Цикл Элонгации включает связывание аминоацил-тРНК (узнавание кодона), образ-ие пептидной связи и транслокацию. Рост цепи происходит в панравлении от N-конца к С-концу. Терминацию синтеза белка осущ-ют факторы освобождении, кот-ые узнают терминирующие кодоны UAA, UGA и UAG =>гидролиз связи между полипептидом и тРНК. При образ-ии 70S-комплекса инициации, при связывании аминоацил-тРНК с рибосомой и на стадии транслокации происходит гидролиз GTP. Разлиные стадии синтеза белка ингиб-ся токсинами и антибиотиками. Пептидные антибиотики и др. короткие полипептиды синтез-ся без рибосом, при этом мех-зм их образ-ия напоминает синтез жир.к-от.
Регуляция трансляции. Стрептомицин ингибирует инициацию и вызывает неправильное считывание иРНК, а пуромицин вызывает преждевременную терминацию цепи, тк имитирует аминоацилированную тРНК, синтез белка терминируется факторами освобождения- это те факторы, которые узнают сигналы терминации.
UAA и UAG узнаются RF1 фактором, а UAA и UGA узнаются вторым фактором освобождения RF2.
