
Shpargalka_po_biohimii(ceccuu.net) / T21
.doc
Б ИЛЕТ
21
ИЛЕТ
21
•Структура и свойства фосфолипидов. Липидный состав биологических мембран - фосфолипиды, гликолипиды, холестерин. Роль липидов в формировании липидного бислоя. Влияние холестерина на возможность латеральной диффузии липидов и белков. Участиефосфолипаз в обмене фосфолипидов.
Билет №17. Вопрос 2.
[Л2] Фосфолип– лип,содерж-е помимо жир к-т и спирта остаток фосфорной к-ты.В их сос часто входят азотистые основ-я и др.компоненты.К ним относ:
1) фосфатидная к-та- явл-ся промежуточ соед-ем в ходе синтеза фосфолипидов. Кардиолипин–фос-липид,содержащийся в мембр митохондрий.
2) Фосфатидилхолин (лецитин)содерж глицерол,жир.к-ты,фосфорную к-ту и холин. Выполн метаболич и структурные ф-ции в мембранах.Его недостаточ-ть может привести к синдрому дыхат-ой недостаточ-ти.
3) Кефалин – отлич от лецитина тем,что холин замещен этаноламином.
4)Фосфатидилсерин – вместо холина Ser.
5)Лизофосфолипид – фосфоацилглицерол,содерж-е1ацетальный радикал(пр. лизолецитин).6)Сфингомиелины – встреч-ся в нерв тк.Глицерола в их составе нет.Сост из жк-от, фосфорной к-ты,холина,сложный аминоспирт сфингозин.
СИНТЕЗ. Нескол путей синтеза фосфолипидов.Синтез de novo начин-ся с образ-я CDP-диацилглицерола из фосфатида и цитидинтрифосфата (CTP).Равновесие р-ии смещ-ся в сторону образ-я продукта из-за гидролиза пирофосфата.Затем активирован фосфатидиловый остаток реагирует с гидроскильной гр-ой полярного спирта.Если в кач полярного спирта использ-ся Ser,то образ-ся фосфатидилсерин и цитидинмонофосфат (CMP).Активированный промежут-ый продукт образ-ся из фосфорилированного субстрата и нуклеозидтрифосфата.Заем он реагирует с гидроксильной гр(с ОН-гр.В 4-ом положении на конце мол-лы гликогена или с гидроксильной гр боковой цепи Ser).
[Л10]
Образование фосфатидилхолина:
В составе биол.мембран – фосфолипиды +гликолипиды (содежат сфингозин; самый простой – цереброзид – содержит 1 остаток глюкозы; ганглиозиды содерж.разветв. цепь из неск.остатков сахаров). +холестерин
Липиды и белки (с разной скоростью в завис-ти от св-в) постоянно перемещаются в латеральном направлении (в плоскости мембраны) ~на несколько микрон за 1 мин.
П![]() оперечная
диффузия (на др.сторону мембраны) –
только для липидов. Простой диффузией
–медленно. Есть спец.интегральные белки
– флиппазы – обеспечивают перенос
фосфолипидов с одной стороны мембраны
на другую.
оперечная
диффузия (на др.сторону мембраны) –
только для липидов. Простой диффузией
–медленно. Есть спец.интегральные белки
– флиппазы – обеспечивают перенос
фосфолипидов с одной стороны мембраны
на другую.
Надо долго говорить про ассиметрию мебран – за счет попер.диффузии, несимметричности мембранных белков и за счет работы насосов (типа Na\K-АТФазы).
Факторы, влияющие на текучесть мембраны: 1.Состав жирных кислот: в упорядоч.состоянии – все С-С связи – в транс-конфигурации, в неупорядоч. – гош-конфигурация. Переход между этими двумя состояниями определяется от длины и насыщенности ацильного остатка (i.e., цис-ненасыщенные ЖК образуют изгиб, след., сложнее упаковываются). 2.Холестерол стерически блокирует сильное перемещение ацильных цепей, поэтому снижает текучесть мембран НО ОДНОВРЕМЕННО препятствует насыщение и более плотной упаковке ЖК (2 противоположных эффекта). В целом эффект холестерина – поддержание текучести на каком-то опр.уровне.
Регуляция текучести: у прокариот – за счет изменения соотношения насыщенных и ненасыщенных ЖК; у эукариот -–за счет холестерола.
•Семейства С4 и С5 аминокислот. Роль оксалоацетата и альфа-кетоглутарата в подключенииуглеродного скелета аминокислот в цикл Кребса
История: исследовали взаимопревращения в-в. Открыли: Ile, Lys, Phe, Tyr, Trp превращ-ся и в гликоген, и в жир; Leu – только в жир; Остальные АК – только в гликоген.
Суть анаболизма АК: сначала – отщепление азота (чаще всего переаминированием) амфиболич.интермедиаты (окисл.углеводороды).
I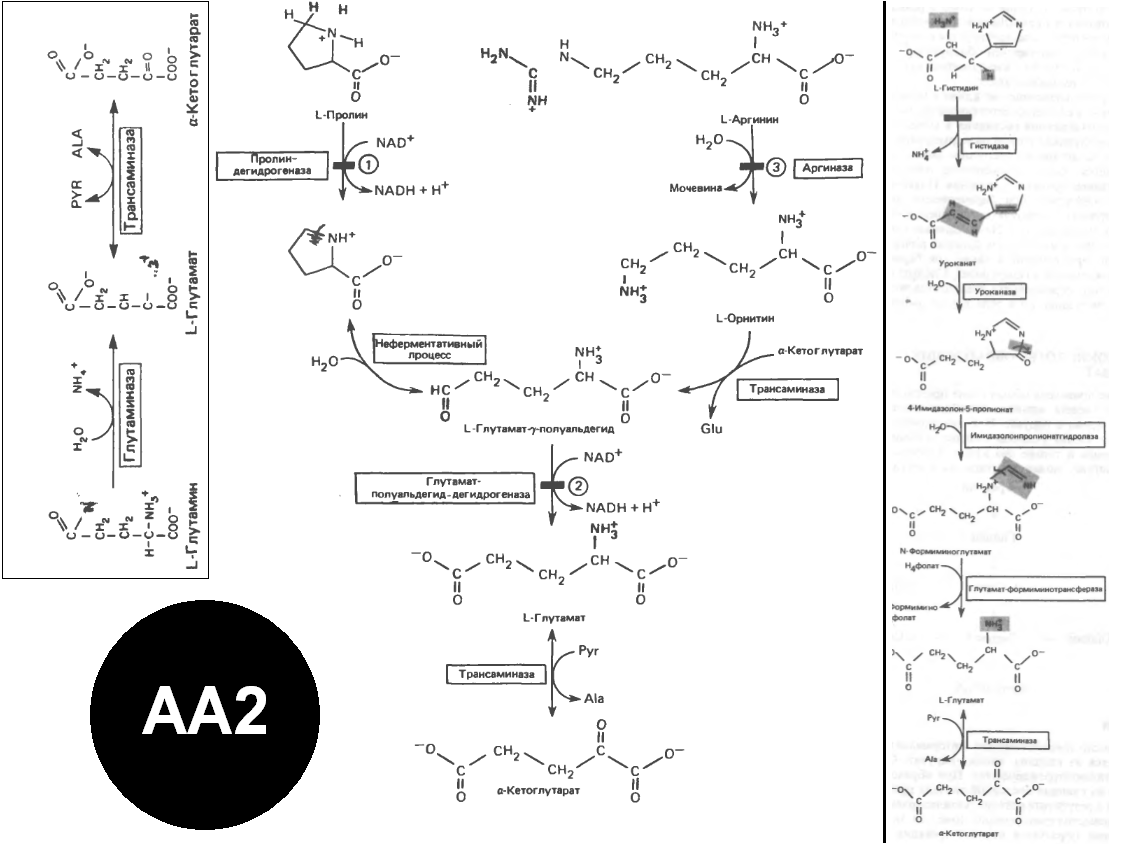 .Аминок-ты,
образующие оксалоацетат.
Аспарагин,
аспартат.
Патологий не выявлено (?не совместимы
с жизнью?). [AA1]
.Аминок-ты,
образующие оксалоацетат.
Аспарагин,
аспартат.
Патологий не выявлено (?не совместимы
с жизнью?). [AA1]
II.Аминок-ты, образующие α-кетоглутарат. [AA2] Глутамин, глутамат. Нарушения (аутосом.-рец.тип, неопасны для здоровья, но – умст.отсталость): Гиперпролинемия типа I (блок пролиндегидрогеназы), типа II (блок глутамат-полуальдегид-дегидрогеназы накопление и гидроксипролина). Аргинин. Блок аргиназы печени гипераргинемия. Гистидин. Блок гистидазы гистидинемия (умст.отсталость и наруш.речи). Не путаем с His при беременности.
•Терминация трансляции. Сворачивание и созревание полипептида.
Когда 1 из
стоп-кодонов(UAG, UAA или UGA)попадает в
Α-участок, наступ терминация трансляции.Для
стоп-кодонов нет соответствующих
тРНК.Вместо этого с рибосомой связыв-ся
2 белковых,высвобождающих
фактора.Один
RF-1, катализирует гидролитическое
расщеп-е эфирной св м/ду тРНК и С-концом
пептида,тем самым высвобождая белок. Е
для диссоциации комплекса на составл-ие
компоненты поставляет ГТФ-содержащий
фактор RF-3.Синтез белка требует выс
энергетич затрат. При присоед-ии одной
ам.к-ты к растущему полипептиду
гидролизуется 4 макроэргические связи.2
мол АТФ гидролиз-ся при активации
ам.к-ты,( АТФ → АМФ + неорганич фосфат),
и 2 мол ГТФ расход-ся во время элонгац.Кроме
того,при инициации и терминации на кажд
мол-лу белка расход-ся по одной молекуле
ГТФ. За связыв-ем аминоацил-тРНК с А-участ
рибосомы происх р-ция транспептидации
м/ду этой аминоацил-тРНК(акцепторный
субстрат)и сидящей в Р-участ мол
пептидил-тРНК(донорный субстрат).Р-ция
привод к замещ остатка тРНК в мол
пептидил-тРНК на остаток аминоацил-тРНК,
так что аминогр аминоацил-тРНК образ
пептидную св с карбоксил гр пептидильного
остатка
![]() Т обр,в проц элонгации в кажд шаге
прочитыв-я триплета и транспептидации
новый аминокис-ый остаток добавл-ся к
карбоксильнконцу (или С-концу)пептида.Др
словами,рост пептида в рибосоме идет
от N-конца
к С-концу. N-концевой сегмент растущего
пептида высов-ся из рибосомы в окруж
среду. Т.к.рибосому окруж физиологич
среда,а не денатурирующий р-р,полипептидная
цепочка в такой среде не мож оставаться
в виде разверн цепи:ее гидрофобные
боковые гр взаим-ют др с др,а гидрофильные-с
окружающей водой и ионами.Это создает
усл для сворач-я,компактизации и
самоорганиз внерибосомной части
растущего полипептида в
пространственную(вторичную и
3-чную)стр-ру.След,сворач-е полипептида
в компактную стр-ру происх по мере его
роста,то есть в теч трансляции,а значит,
тоже полярно,от N-конца к С-концу.Такое
постепенное полярное сворач-е растущей
полипептид цепи на рибосоме обознач
как котрансляционное формирование
стр-ры белка(котрансляционное
сворачивание).Транспорт белков ч/з мембр
требует несвернутого сост их полипептидной
цепи. В таких случаях используются две
альтернативные стратегии: 1) рибосомы,
синтезирующие белок,предназначен для
транспорта ч/з мембр,сами сидят на
мембране(мембраносвязанные рибосомы),и
растущий полипептид в развернутом виде
поступает из них непосредственно в
мембрану;2) свободные(не прикреплен к
мембране)рибосомы цитопл синтез-ют
полипептидную цепь,кот по мере выхода
из рибосомы взаимод-ет со спец
белками-молекулярными шаперонами.Шапероны
препятств полному сворачив-ю белка в
компактную стр-ру и поддерж-ют его
недосвернутое состояние в р-ре.После
освобожд-я из рибосомы эти недосвернутые
белки взаимод-ют с мембр и транспортируются
ч/з нее.Поддержание недосвернутого сост
белков шаперонами может требоваться
также и для интеграции этих белков в
надмолекулярные стр-ры кл,для сборки
четвертичных стр-р сложных белков,для
вступления в комплексы с некот лигандами
и т.п.В этих случ белки досворачиваются
уже в составе указанных стр-р и комплексов.
Т обр,в проц элонгации в кажд шаге
прочитыв-я триплета и транспептидации
новый аминокис-ый остаток добавл-ся к
карбоксильнконцу (или С-концу)пептида.Др
словами,рост пептида в рибосоме идет
от N-конца
к С-концу. N-концевой сегмент растущего
пептида высов-ся из рибосомы в окруж
среду. Т.к.рибосому окруж физиологич
среда,а не денатурирующий р-р,полипептидная
цепочка в такой среде не мож оставаться
в виде разверн цепи:ее гидрофобные
боковые гр взаим-ют др с др,а гидрофильные-с
окружающей водой и ионами.Это создает
усл для сворач-я,компактизации и
самоорганиз внерибосомной части
растущего полипептида в
пространственную(вторичную и
3-чную)стр-ру.След,сворач-е полипептида
в компактную стр-ру происх по мере его
роста,то есть в теч трансляции,а значит,
тоже полярно,от N-конца к С-концу.Такое
постепенное полярное сворач-е растущей
полипептид цепи на рибосоме обознач
как котрансляционное формирование
стр-ры белка(котрансляционное
сворачивание).Транспорт белков ч/з мембр
требует несвернутого сост их полипептидной
цепи. В таких случаях используются две
альтернативные стратегии: 1) рибосомы,
синтезирующие белок,предназначен для
транспорта ч/з мембр,сами сидят на
мембране(мембраносвязанные рибосомы),и
растущий полипептид в развернутом виде
поступает из них непосредственно в
мембрану;2) свободные(не прикреплен к
мембране)рибосомы цитопл синтез-ют
полипептидную цепь,кот по мере выхода
из рибосомы взаимод-ет со спец
белками-молекулярными шаперонами.Шапероны
препятств полному сворачив-ю белка в
компактную стр-ру и поддерж-ют его
недосвернутое состояние в р-ре.После
освобожд-я из рибосомы эти недосвернутые
белки взаимод-ют с мембр и транспортируются
ч/з нее.Поддержание недосвернутого сост
белков шаперонами может требоваться
также и для интеграции этих белков в
надмолекулярные стр-ры кл,для сборки
четвертичных стр-р сложных белков,для
вступления в комплексы с некот лигандами
и т.п.В этих случ белки досворачиваются
уже в составе указанных стр-р и комплексов.
