
ответы на экз билеты беха / билет 3
.docxБилет 3
1. Гидрофоб взаимод, а так же ионные и водородные связи относятся к числу слабых. Поддержание конформации возможно благодаря возникновению множ слабых связей между участками полипептид цепи. Белки сост из огромного числа атомов, наход в постоянном движении, что приводит к небольшим перемещениям отдельных участков полипептид цепи, кот обычно не наруш общую структуру белка и его ф-ции. Т.е. белки облад конформационной лабильностью – склонностью к небольшим изменениям конформации за счёт разрыва одних и образ других слаб связей.
Конформ белка может меняться при изменении хим и физич св-в среды, а так же при взаимодействии белка с др молекулами. Разрыв большого колич слаб связей в молекуле белка приводит к разрушению её нативной информации. Так как разрыв связей ностит случ хар-р, то молекулы одного индивид. белка преобретают в р-ре форму случайно сформир беспорядочных клубков, отличающихся друг от друга трёхмерной стр-рой. Потеря нативной инф сопровождается утратой специфич ф-и белков. Этот процесс носит назв денатурация. При денатурации белков не происходит разрыва пептид связей, т.е. первич стр-ра не нарушается.
Факторы, выз денатурацию:
выс температура >50гр, интенсив встряхивание р-ра, приводящее к соприкосновению белковых молекул с воздуш средой на пов раздела фаз и изменению конф этих молекул, орг в-ва (спирт, фенол, мочивина) способны взаимодейств с функц группами белков, что приводит к их конформационным изменениям, кисл и щёлочи (изменяя pH среды выз перераспределение связей в молекуле белка), соли тяж металлов (Cu, Hg) образ прочные связи с важными функц группами белков, гетергенты (мыло) в-ва, содерж гидрофобный углеводородный радикал и гидрофильную функц группу.
Шапероны – белки, способные связываться с белками, находящимся в неустойчивом состоянии. Они способны стабилизировать их конформацию. Шапероны, участывующие в защите клет. белков от денатурирующих воздействий относятся к белкам теплового шока(БТШ).При действии различных стрессовых факторов в клетках усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично денатурированных белков они могут препятствовать их полной денатурации и восстанавливать нативную структуру белков.
ВМС, с мм от 100 до 110 кД;Ш-90 - с мм от 83 до 90 кД;Ш-70 –с мм от 66 до 78 кД;Ш-60;Ш-40;НМС шапероны с мм от 15 до 30 кД.
В период синтеза белка на рибосоме защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Ш-70.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60.Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки происходит перебор возможных конформации белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация.
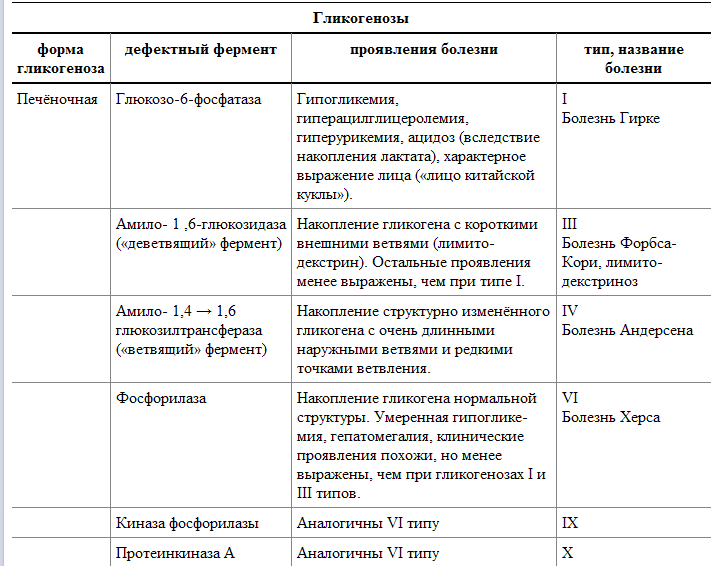
2. Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). В клетках животных гликоген - основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке.
(см.листочек)
Гликогенолиз. 1. Гидролитический – при участии амилазы с образованием декстринов и даже свободной глюкозы.
2. Фосфоролитический – под действием фосфорилазы и образованием глюкозо-1-фосфата. Это основной путь распада гликогена.
Расщепл гликогена начин с нередуцирующего конца полисахарид цепи. При этом наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно. Гликогенфосфорилаза расщепл только α-1,4-гликозидн связи. Последоват отщепл глюкозных остатков прекращ, когда до точки ветвл остаётся 4 мономера. Дальнейший распад гликогена требует участия 2 др ферментов. Сначала 3 оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы на нередуцирующий конец сосед цепи, удлиняя её и создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы, после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Считают, что перенос 3 остатков глюкозы и удаление мономера из точки ветвления катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют "деветвящим" ферментом. Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути.
Поскольку синтез и распад гликогена протекают по разным метаболическим путям, эти процессы могут контролироваться реципрокно. Влияние гормонов на синтез и распад гликогена осуществляется путем изменения в противоположных направлениях активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования. Инсулин стимулирует синтез гликогена и тормозит распад, адреналин и глюкагон обладают противоположным эффектом.

3. Основными компонентами межклеточного хрящевого матрикса являются коллаген II типа, агрекан, гиалуроновая кислота и вода. Кроме них в матриксе находятся малые протеогликаны, коллагены VI, IX, XI типов, связывающий белок, другие неколлагеновые белки фибронектин, анкорин, хрящевой олигомерный белок, хондроадгерин, разнообразные ростовые факторы.
Высокомолекулярные агрегаты состоящие из агрекана и гиалуроновой кислоты являются полианионами, так как содержат большое количество кислых групп. Это способствует высокой гидратации хрящевого матрикса и обеспечивает выполнение им рессорных функций. Содержание воды в суставном хряще непостоянно. При нагрузке жидкость вытесняется, пока давление набухания не уравновесит внешнюю нагрузку, когда нагрузка прекращается, вода вновь возвращается в хрящ. Очень наглядно это проявляется в межпозвоночных дисках. Утром после сна на долю воды приходится около 75% массы диска. При внешней нагрузке на диски в течение дня,содержание воды уменьшается примерно на 20 %. Поэтому рост человека к вечеру уменьшается на 1 -2 см, а космонавты в невесомости становятся выше почти на 5 см.
