
ответы на экз билеты беха / билет 5
.docxБилет 5
1. По форме.Глобулярные.Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде(гемоглобин).Фибриллярные белки имеют вытянутую, нитевидную структуру(коллагены, эластин, кератин, миозин и тд).По хим строению.Простые белки содержат в своём составе только полипептидные цепи, состоящие из амк остатков(гистоны).Сложные белки кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. (гемопротеины,фосфопротеины,гликопротеины,металлопротеины).По функциям.Ферменты - специализированные белки, ускоряющие течение химических реакций.Регуляторные белки группа белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени. Кроме того, к регуляторным относят белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию.Рецепторные белки сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами.Транспортные белки(альбумин переносит жирные кислоты и билирубин, а гемоглобин эритроцитов участвует в переносе О2 от лёгких к тканям и тд).Структурные белки(коллаген,эластин)Защитные белки(иммуноглобулины,фибриноген,тромбин).Сократительные белки(актин,миозин).
Семейство сериновых протеаз.Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках.
Для всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102. Некоторые амк замены привели к изменению субстр. специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами. Семейство иммуноглобулинов Иммуноглобулины, или антитела, - специф. белки, вырабатываемые В-лимф в ответ на попадание в организм чужерод структур, называемых антигенами. Все иммуноглобулины характеризуются общим планом строения.
Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких L, содержащих около 220 амк остатков, и двух тяжёлых Н, состоящих из 440 амк каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG относят к мономерам.
Лёгкие цепи состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипепт цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена.Тяжёлые цепи имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3).Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость.Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют "биваленты". В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных доменов обеих цепей, а всего лишь 20-30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальные способности каждого клона антител взаимодействовать с соответствующим (комплементарным) антигеном.

Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ξ, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A, D, Е, G и М.
IgM обеспеч первичный иммунный ответ.Структура является наиболее крупномолекулярной. Его молекула являет собой соединенные специальной связью в единую структуру пять мономеров, другими словами: обладает десятью активными центрами. Поскольку иммуноглобулин M определяется в человеческом организме еще до пересечения его с антигеном, то именно он формирует блок естественных антител и является антигенраспознающим рецептором В-лимфоцитов в мономерной форме.В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков.В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. IgА. Основной класс антител, присутствующий в секретах желёз.Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J.Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм. IgЕ. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток.Увеличение количества IgE может предшествовать развитию аллергических реакций. IgD.обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.
2.

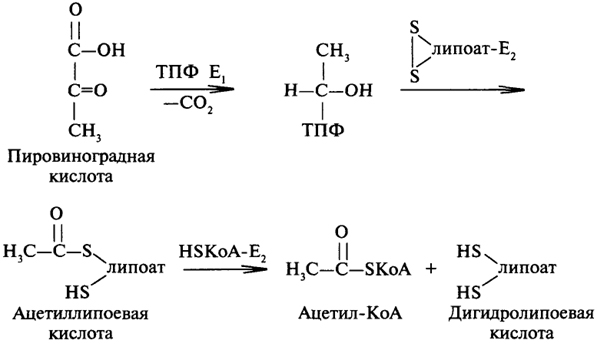
В аэробных усл ПВК окисляется; этот процесс называется окислительным декарбоксилированием. Катализирует этот процесс мультиэнзимный комплекс, который называется пируватдегидрогеназным комплексом. В состав этого комплекса входят три фермента и пять коферментов.1декарбоксилирование ПВК , катализир пируватдекарбоксилазой (E1), коферментом которой является тиаминпирофосфат. В результате образуется оксиэтильный радикал, ковалентно связанный с коферментом. Фермент, ускоряющий второй этап окислительного декарбоксилирования ПВК, - липоат-ацетилтрансфераза содержит в своем составе два кофермента: липоевую кислоту и коэнзим A (KoASH). Происходит окисление оксиэтильного радикала в ацетильный, который сначала акцептируется липоевой кислотой, а затем переносится на KoASH. Результатом второго этапа является образование ацетил-КоА и дегидролипоевой кислоты. Заключительную стадию окислительного декарбоксилирования ПВК катализирует дигидролипоилдегидрогеназа, коферментом которой является ФАД. Кофермент отщепляет два атома водорода от дигидролипоевой кислоты, тем самым воссоздавая первоначальную структуру данного кофермента.
![]()
Конечным акцептором атомов водорода является НАД: ФАД · 2Н + НАД+ → ФАД + НАДН + Н+
Суммарная схема процесса может быть представлена в виде:
![]()
Обр в гликолизе пируват в аэробных условиях превращ в ПВК-‑дегидрогеназном комплексе в ацетил-S-КоА, при этом образуется 1 молекула НАДН.Ацетил-S-КоА вовлекается в ЦТК и, окисляясь, дает 3 молекулы НАДН, 1 молекулу ФАДН2, 1 молекулу ГТФ. Молекулы НАДН и ФАДН2 движутся в дыхательную цепь, где при их окислении в сумме образуется 11 молекул АТФ. В целом при сгорании одной ацетогруппы в ЦТК образуется 12 молекул АТФ.Суммируя результаты окисления "гликолитического" и "пируватдегидрогеназного" НАДН, "гликолитический" АТФ, энергетический выход ЦТК и умножая все на 2, получаем 38 молекул АТФ.Значение: Гликолиз — катаболич путь исключит важности. Он обеспеч энергией клеточные реакции, в том числе и синтез белка. Промежут продукты гликолиза использ при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и др соед. Благодаря гликолизу производительность митохондрий и доступность кислорода не огранич мощность мышц при кратковрем предельных нагрузках.
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:1.при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,2.при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
3. на основании жалоб, осмотра и приведенных исследований установлен IV тип ГЛП. Причиной заболевания часто служит дефицит активатора ЛПЛ — белка апоС-П, что приводит к нарушению катаболизма ХМ и ЛПОНП. Заболевание клинически проявляется гепатоспленомегалией, абдоминальной коликой, ксантоматозом и иногда ИБС. Больные имеют повышенный риск развития панкреатита.
