
- •С.А. Сергеева, в.Е. Рябинин Практикум по химии
- •Рекомендовано
- •Оглавление
- •Введение
- •Тема: Тепловые эффекты химических реакций. Термодинамические характеристики химических и биохимических процессов
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть Лабораторная работа. Определение стандартной теплоты (энтальпии) реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Кинетика химических и биохимических реакций. Химическое равновесие
- •1. Основные понятия химической кинетики:
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть
- •Зависимость скорости разложения от ее концентрации //
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Приложения а
- •Значения теплоты сгорания некоторых органических веществ, применяемых в медицине
- •Список литературы Основная литература
- •Дополнительная литература
1. Основные понятия химической кинетики:
истинная и средняя скорость химической реакции и математическое выражение скорости реакции;
простые и сложные реакции (параллельные, последовательные, сопряженные, цепные);
гомогенные и гетерогенные реакции;
молекулярность и порядок реакции.
1.2. Зависимость скорости реакции от концентрации. Кинетические уравнения реакций нулевого, первого и второго порядков. Константа скорости реакции. Период полупревращения.
1.3. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции. Уравнение Аррениуса. Энергии активации. Энергетический профиль реакции. Теория активных соударений и переходного состояния.
1.4. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Ферментативный катализ в биологических системах. Уравнение Михаэлиса-Ментен.
1.5. Константа химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье.
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
1. Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7)с алгоритмами их решений, эталонами ответов и с комментариями.
Вычисление скорости, константы и температуры коэффициента скорости реакции
Задача
№ 1.
Взаимодействие
![]() со свободным кислородом приводит к
образованию высокотоксичного диоксида
азота /
со свободным кислородом приводит к
образованию высокотоксичного диоксида
азота /![]() /,
хотя эта реакция в физиологических
условиях протекает медленно и при низких
концентрациях
/,
хотя эта реакция в физиологических
условиях протекает медленно и при низких
концентрациях![]()
![]()
![]() не
играет существенной роли в токсическом
повреждении клеток, но, однако патогенные
эффекты резко возрастают при его
гиперпродукции. Определите, во сколько
раз возрастает скорость взаимодействия
оксида азота (II)
c
кислородом при увеличении давления в
смеси исходных газов в два раза, если
скорость реакции
не
играет существенной роли в токсическом
повреждении клеток, но, однако патогенные
эффекты резко возрастают при его
гиперпродукции. Определите, во сколько
раз возрастает скорость взаимодействия
оксида азота (II)
c
кислородом при увеличении давления в
смеси исходных газов в два раза, если
скорость реакции
![]() описывается уравнением
описывается уравнением![]() ?
?
Решение.
Увеличение давления вдвое равноценно двойному увеличению концентрации (с)
 и
и
 .
Поэтому скорости взаимодействия,
соответствующие
.
Поэтому скорости взаимодействия,
соответствующие
 и
и
 ,
примут
в соответствии с законом действия масс
выражения:
,
примут
в соответствии с законом действия масс
выражения:
 и
и
Ответ. Скорость реакции увеличится в 8 раз.
Задача
№ 2. Считается,
что концентрация хлора (зеленоватый
газ с резким запахом) в воздухе выше 25
ppm опасна для жизни и здоровья, но, имеются
данные, что если пациент восстановился
после острого тяжелого отравления этим
газом, то остаточных явлений не
наблюдается. Определите, как изменится
скорость реакции:
![]() ,
протекающей в газовой фазе, если увеличить
в 3-и раза: концентрацию
,
протекающей в газовой фазе, если увеличить
в 3-и раза: концентрацию![]() ,
концентрацию
,
концентрацию![]() ,
3) давление /
,
3) давление /![]() /?
/?
Решение.
Если обозначить концентрации
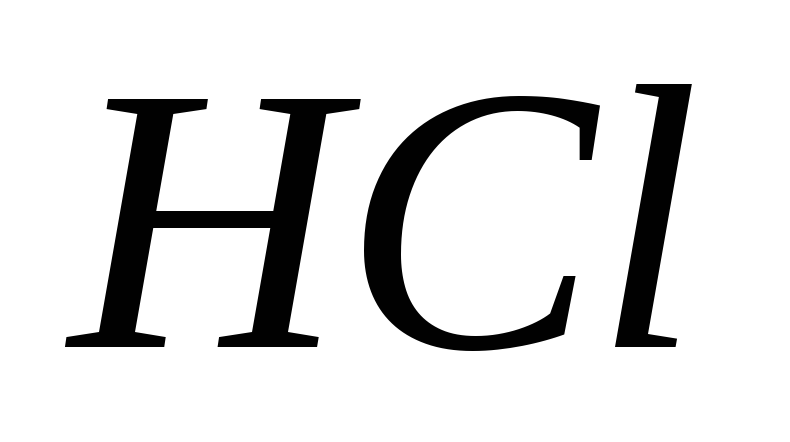 и
и соответственно через
соответственно через и
и ,
то выражение для скорости реакции
примет вид:
,
то выражение для скорости реакции
примет вид: .
.После увеличения концентраций в 3-и раза они будут равны
 для
для и
и для
для .
Поэтому выражение для скорости реакции
примет вид: 1)
.
Поэтому выражение для скорости реакции
примет вид: 1) 2)
2)
Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому

Увеличение скорости реакции по отношению к первоначальной определяется отношением соответственно: 1)
 ,
2)
,
2) ,
3)
,
3) .
.
Ответ.
Скорость реакции увеличится в: 1) , 2)
![]() ,
3)
,
3)![]() раза.
раза.
Задача
№ 3. Как
изменяется скорость взаимодействия
исходных веществ при изменении температуры
с
![]() до
до![]() ,
если температурный коэффициент реакции
равен 2,5?
,
если температурный коэффициент реакции
равен 2,5?
Решение.
Температурный коэффициент
 показывает, как меняется скорость
реакции при изменении температуры на
каждые
показывает, как меняется скорость
реакции при изменении температуры на
каждые (правило
Вант-Гоффа):
(правило
Вант-Гоффа):
 .
.Если же изменение температуры:
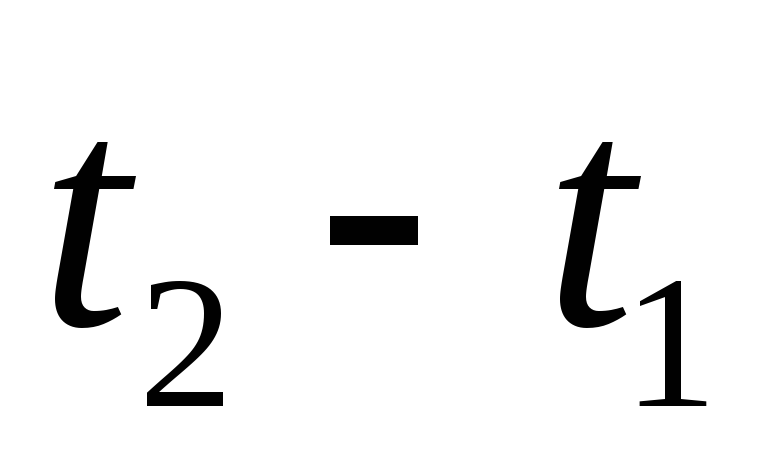 ,
то с учетом того, что
,
то с учетом того, что ,
получаем:
,
получаем: .
Отсюда,
.
Отсюда, .
.По таблице антилогарифмов находим:
 .
.
Ответ. При изменении температуры (т.е. при повышении) скорость увеличится в 67,7 раз.
Задача
№ 4. Вычислите
температурный коэффициент![]() скорости реакции, зная, что с повышением
температуры на
скорости реакции, зная, что с повышением
температуры на![]() скорость возрастает в 128 раз.
скорость возрастает в 128 раз.
Решение.
Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа:
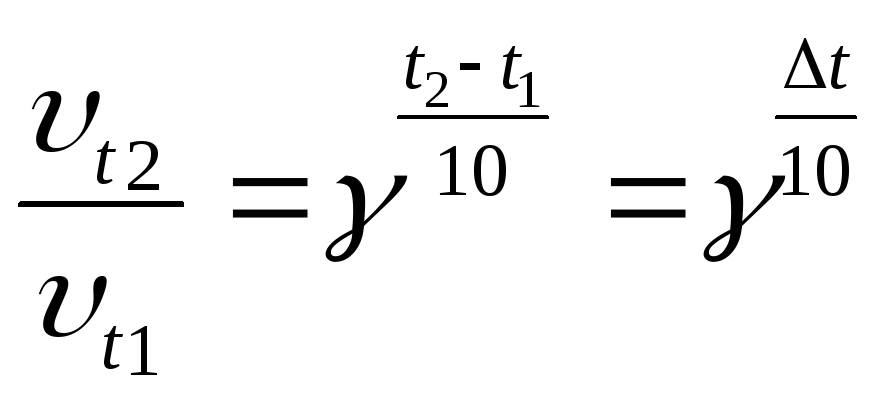 .Решая
уравнение относительно
.Решая
уравнение относительно![]() ,
находим:
,
находим:![]() ,
,![]() .
Следовательно,
.
Следовательно,![]() =2
=2
Ответ.
![]() =2.
=2.
Задача
№ 5. Для одной
из реакций были определены две константы
скорости: при
![]() 0,00670
и при
0,00670
и при![]() 0,06857.
Определите константу скорости этой же
реакции при
0,06857.
Определите константу скорости этой же
реакции при![]() .
.
Решение.
По двум значениям констант скорости реакции, используя уравнение Аррениуса, определяем величину энергии активации реакции:
 .
Для данного случая:
.
Для данного случая:
 Отсюда:
Отсюда: Дж/моль.
Дж/моль.Рассчитаем константу скорости реакции при
 ,
используя в расчетах константу скорости
при
,
используя в расчетах константу скорости
при и
уравнение Аррениуса:
и
уравнение Аррениуса: .
Для данного случая:
.
Для данного случая:
 и с учетом того, что:
и с учетом того, что: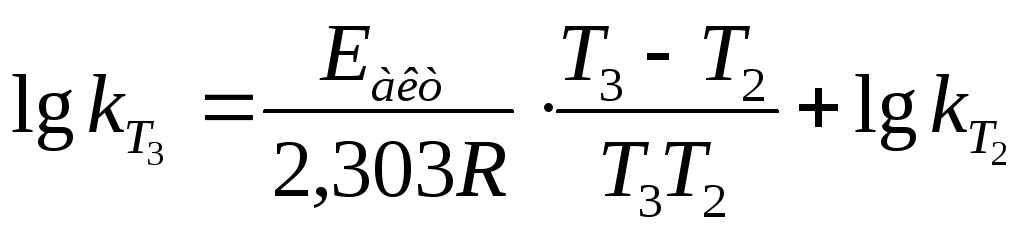 ,
получаем:
,
получаем: .
Следовательно,
.
Следовательно,
Ответ.
![]()
Вычисление константы химического равновесия и определение направление смещения равновесия по принципу Ле-Шателье.
Задача
№6. Двуокись
углерода /![]() /
в отличие от моноксида углерода /
/
в отличие от моноксида углерода /![]() /
не нарушает физиологических функций и
анатомической целостности живого
организма и удушающий эффект их обусловлен
лишь присутствием в высокой концентрации
и снижением процентного содержания
кислорода во вдыхаемом воздухе. Чему
равнаконстанта
равновесия реакции
/
/
не нарушает физиологических функций и
анатомической целостности живого
организма и удушающий эффект их обусловлен
лишь присутствием в высокой концентрации
и снижением процентного содержания
кислорода во вдыхаемом воздухе. Чему
равнаконстанта
равновесия реакции
/![]() /:
/:![]() при температуре
при температуре![]() ,
выраженная через: а) парциальные давления
реагирующих веществ
,
выраженная через: а) парциальные давления
реагирующих веществ![]() ;
б) их молярные концентрации
;
б) их молярные концентрации![]() ,
зная, что состав равновесной смеси
выражается объемными долями:
,
зная, что состав равновесной смеси
выражается объемными долями:![]()
![]() ,
,![]()
![]() и
и![]()
![]() ,
а общее давление в системе составляет
,
а общее давление в системе составляет![]() Па?
Па?
Решение.
Парциальное давление газа равно общему давлению, умноженному на объемную долю газа в смеси, поэтому:
а)
![]() Па;
Па;
б)
![]() Па;
Па;
в)
![]() Па;
Па;
Подставляя эти значения в выражение константы равновесия, получим:
 Па.
Па.
Взаимосвязь между
 и
и устанавливается на основе уравнения
Менделеева Клапейрона для идеальных
газов и выражается равенством:
устанавливается на основе уравнения
Менделеева Клапейрона для идеальных
газов и выражается равенством: ,
где
,
где –
разность между числом молей газообразных
продуктов реакции и газообразных
исходных веществ. Для данной реакции:
–
разность между числом молей газообразных
продуктов реакции и газообразных
исходных веществ. Для данной реакции: .
Тогда:
.
Тогда:
 .
.
Ответ.![]() Па.
Па.![]()
![]() .
.
Задача № 7. В каком направлении сместится равновесие в следующих реакциях:

 ;
;
 ;
;
 ;
;
а) при повышении температуры, б) при понижении давления, в) при увеличении концентрации водорода?
Решение.
Химическое равновесие в системе устанавливается при постоянстве внешних параметров (
 и др.). Если эти параметры меняются, то
система выходит из состояния равновесия
и начинает преобладать прямая (вправо)
или обратная реакции (влево). Влияние
различных факторов на смещение
равновесия отражено в принципе Ле
Шателье.
и др.). Если эти параметры меняются, то
система выходит из состояния равновесия
и начинает преобладать прямая (вправо)
или обратная реакции (влево). Влияние
различных факторов на смещение
равновесия отражено в принципе Ле
Шателье.Рассмотрим влияние на вышеуказанные реакции всех 3-х факторов, влияющих на химическое равновесие.
а)
При повышении
температуры равновесие смещается в
сторону эндотермической реакции, т.е.
реакции, идущей с поглощением тепла.
1-я и 3-я реакции – экзотермические /![]() /,
следовательно, при повышении температуры
равновесие сместится в сторону обратной
реакции, а во 2-ой реакции /
/,
следовательно, при повышении температуры
равновесие сместится в сторону обратной
реакции, а во 2-ой реакции /![]() /
– в сторону прямой реакции.
/
– в сторону прямой реакции.
б) При понижении давления равновесие смещается в сторону возрастания числа молей газов, т.е. в сторону большего давления. В 1-ой и 3-ей реакциях в левой и правой частях уравнения будет одинаковое число молей газов (2-2 и 1-1 соответственно). Поэтому изменение давления не вызовет смещения равновесия в системе. Во 2-ой реакции в левой части 4 моля газов, в правой – 2 моля, поэтому при понижении давления равновесие сместится в сторону обратной реакции.
в) При увеличении концентрации компонентов реакции равновесие смещается в сторону их расхода. В 1-ой реакции водород находится в продуктах, и увеличение его концентрации усилит обратную реакцию, в ходе которой он расходуется. Во 2-ой и 3-ей реакциях водород входит в число исходных веществ, поэтому увеличение его концентрации смещает равновесие в сторону реакции, идущей с расходом водорода.
Ответ.
а) При повышении температуры в реакциях 1 и 3 равновесие будет смещено влево, а в реакции 2 – вправо.
б) На реакции 1 и 3 понижение давления не повлияет, а в реакции 2 – равновесие будет смещено влево.
в) Повышение температуры в реакциях 2 и 3 повлечет за собой смещение равновесия вправо, а в реакции 1 – влево.
1.2. Ситуационные задачи №№ с 8 по 21 для закрепления материала (выполнить в протокольной тетради).
Задача № 8. Как изменится скорость
окисления глюкозы в организме при
снижении температуры с![]() до
до![]() ,
если температурный коэффициент скорости
реакции равен 4 ?
,
если температурный коэффициент скорости
реакции равен 4 ?
Задача № 9. Используя приближенное правило Вант-Гоффа, вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз? Температурный коэффициент скорости принять равным 3.
Задача № 10. Для практической
остановки реакции применяют быстрое
охлаждение реакционной смеси
(«замораживание реакции»). Определите,
во сколько раз изменится скорость
реакции при охлаждении реакционной
смеси с 40 до
![]() ,
если температурный коэффициент реакции
равен 2,7.
,
если температурный коэффициент реакции
равен 2,7.
Задача № 11. Изотоп![]()
![]() ,
применяющийся для лечения некоторых
опухолей, имеет период полураспада 8,1
суток. Через какое время содержание
радиоактивного йода в организме пациента
уменьшится в 5 раз?
,
применяющийся для лечения некоторых
опухолей, имеет период полураспада 8,1
суток. Через какое время содержание
радиоактивного йода в организме пациента
уменьшится в 5 раз?
Задача № 12. Гидролиз некоторого
синтетического гормона (фармпрепарата)
является реакцией первого порядка с
константой скорости 0,25![]() (
(![]() ).
Как изменится концентрация этого гормона
через 2 месяца?
).
Как изменится концентрация этого гормона
через 2 месяца?
Задача №13. Период полураспада
радиоактивного![]() равен 5600 лет. В живом организме за счет
обмена веществ поддерживается постоянное
количество
равен 5600 лет. В живом организме за счет
обмена веществ поддерживается постоянное
количество![]() .
В останках мамонта содержание
.
В останках мамонта содержание![]() составило
составило![]() от
исходного. Определите, когда жил мамонт?
от
исходного. Определите, когда жил мамонт?
Задача
№ 14. Период
полураспада инсектицида (ядохимиката,
применяемого для борьбы с насекомыми)
составляет 6 месяцев. Некоторое количество
его попало в водоем, где установилась
концентрация
![]() моль/л. За какое время концентрация
инсектицида понизится до уровня
моль/л. За какое время концентрация
инсектицида понизится до уровня![]() моль/л?
моль/л?
Задача №15. Жиры и углеводы окисляются с заметной скоростью при температуре 450 — 500°, а в живых организмах — при температуре 36 — 40°. В чем причина резкого уменьшения температуры, необходимой для окисления?
Задача № 16. Пероксид
водорода разлагается в водных растворах
на кислород и воду. Реакцию ускоряют
как неорганический катализатор (ион
![]() ),
так и биоорганический (фермент каталаза).
Энергия активации реакции в отсутствие
катализатора 75,4 кДж/моль. Ион
),
так и биоорганический (фермент каталаза).
Энергия активации реакции в отсутствие
катализатора 75,4 кДж/моль. Ион![]() снижает ее до 42 кДж/моль, а фермент
каталаза — до 2 кДж/моль. Рассчитайте
соотношение скоростей реакции в
отсутствие катализатора в случаях
присутствия
снижает ее до 42 кДж/моль, а фермент
каталаза — до 2 кДж/моль. Рассчитайте
соотношение скоростей реакции в
отсутствие катализатора в случаях
присутствия![]() и каталазы. Какой вывод можно сделать
об активности фермента? Реакция протекает
при температуре 27 °С.
и каталазы. Какой вывод можно сделать
об активности фермента? Реакция протекает
при температуре 27 °С.
Задача № 17 Константа скорости
распада пенициллина при![]() равна
равна![]()
![]() ,
а при
,
а при![]()
![]() .
Определите температурный коэффициент
скорости и энергию активации реакции.
.
Определите температурный коэффициент
скорости и энергию активации реакции.
Задача №16. Раствор лекарственного вещества содержит 1500 активных единиц в 1 мл. Через 20 дней концентрация активных единиц снижается до 120 единиц в мл. Рассчитайте константу скорости и период полупревращения, если реакция протекает по первому порядку.
Задача №18. Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Задача № 19. Какими способами в
системе
![]() можно смещать равновесие в сторону
большого выхода
можно смещать равновесие в сторону
большого выхода![]() при заданной концентрации
при заданной концентрации
![]() ?
?
Задача №20. При состоянии равновесия
системы![]() концентрация
азота 0,3 моль/л; водорода 0,9 моль/л; аммиака
0,4 моль/л. Вычислите константу равновесия
реакции и исходные концентрации азота
и водорода.
концентрация
азота 0,3 моль/л; водорода 0,9 моль/л; аммиака
0,4 моль/л. Вычислите константу равновесия
реакции и исходные концентрации азота
и водорода.
Задача
№ 21. Метанол
является сильным нервно - сосудистым
ядом, обладающим выраженными кумулятивными
свойствами и при поступлении в
желудочно-кишечный тракт быстро
всасывается и через 1 ч. начинает
циркулировать в крови, где может быть
обнаружен в течение 3-4 дней. Вычислите
константу равновесия реакции образования
метилового спирта:![]() при
стандартных условиях, если
при
стандартных условиях, если![]() и
и![]() кДж/моль;
кДж/моль;![]() ,
,![]() и
и![]()
![]() Дж/моль.
Дж/моль.
