
- •Основы химических знаний судебного эксперта: задачи и упражнения
- •Тема 1. Основные понятия и законы химии
- •Тема 2. Расчеты по уравнениям химических реакций
- •Тема 3. Строение атомов и молекул
- •2. Метод валентных связей (мвс)
- •Практические задания
- •Тема 4. Комплексные соединения
- •Практические задания
- •Тема 5. Химическая кинетика. Химическое равновесие
- •Тема 6. Растворы
- •Тема 7. Растворы электролитов
- •Практические задания
- •Тема 8. Окислительно-восстановительные реакции
- •Практические задания
- •Приложения
- •Список рекомендуемой литературы
- •Содержание
- •Веколова Виктория Владимировна
2. Метод валентных связей (мвс)
В основе два положения:
- ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта пара электронов принадлежит двум атомам;
- ковалентная связь тем прочнее, чем больше степень перекрывания взаимодействующих электронных облаков.
МВС введено понятие валентности, которая определяется числом неспаренных электронов, и объяснена переменная валентность многих элементов.
МВС предложены два механизма образования ковалентной связи:
- обменный, при котором каждый атом предоставляет для образования связи один неспаренный электрон;
- донорно-акцепторный, при котором один атом (донор) предоставляет для образования связи пару электронов, а другой атом (акцептор) – свободную орбиталь.
МВС введено понятие гибридизации атомных орбиталей– смешении их и выравнивании по форме и энергии.
В соответствии с экспериментальными данными считают, что не происходит гибридизации атомных орбиталей центрального атома в следующих молекулах: H2S,PH3,PHal3,AsH3,AsHal3,SbH3,SbHal3.
Согласно МВС существует два способа перекрывания атомных орбиталей:
- вдоль линии связи – образуется σ-связь (при перекрыванииs-орбиталей и рх-орбиталей);
- по обе стороны от линии связи – образуется π-связь (при перекрывании рy-орбиталей и рz-орбиталей).
МВС предложен метод определения пространственной структуры молекул, которая определяется взаимодействием связывающих электронных пар молекулы друг с другом и неподеленными (несвязывающими) парами электронов центрального атома.
Определение геометрической формы молекул и ионов
|
Тип гибридизации атомных орбиталей центрального атома |
Возможная геометрическая форма молекул (ионов) |
|
sp |
линейная, угловая |
|
sp2 |
треугольник, угол |
|
sp3 |
тетраэдр, треугольник, угол |
|
sp3d2 |
октаэдр |
Пример:Определить тип гибридизации атома серы и пространственную структуру молекулы SO2.
Решение:
1. Определить валентности элементов и записать структурную формулу молекулы: валентность атома серы (IV), кислорода (II) ; структурная формула: О=S=О.
2. Составить электронно-графическую формулу валентного уровня атома серы:
3d__ __ __ __ __

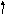
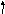
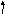 3p__ __ __
3p__ __ __
3
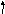 s__
s__

Чтобы атом серы мог проявить валентность IV, у него должно быть 4 неспаренных электрона, что достигается при переходе одного электрона с 3p-подуровня на свободную орбиталь 3d-подуровня.
3. Определить число гибридных орбиталей атома серы, которое определяется суммой числа σ-связей и числа неподеленных пар электронов на валентном уровне атома серы. Атом серы образует 2 σ-связи с атомами кислорода и имеет одну неподеленную пару электронов, то есть число гибридных орбиталей равно 3. Отсчитываем три орбитали, начиная с 3s-орбитали и определяем, что тип гибридизацииsр2.
4. Так для образования треугольника в молекуле SO2 не хватает одной вершины, пространственная структура – угловая.
Практические задания
3.1.Составьте электронную и электронно-графическую формулы элементов: Са,Al,Hf. Используя только Периодическую систему элементов Д.И. Менделеева, дайте характеристику элементов по указанному плану.
3.2.Объясните два механизма образования связи на примере частиц РН3и РН4+ .
3.3.Объясните два механизма образования связи на примере частиц ВF3и ВF4-.
3.4.Определите возможные валентности атома хлора, фосфора, углерода.
3.5.Определить тип гибридизации и геометрическую форму молекулы (иона):BeF2,AlF3,SiCl4, SO3,SO42-.
3.6.Определить тип гибридизации и геометрическую форму молекулы (иона): Н2О,NH3,SiCl4, CO2,SO32-.
3.7.Определить тип гибридизации и геометрическую форму молекулы (иона):ClO3-,ClO-, РН3.
