
- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
Механизмы протекания химических реакций
Механизмом химической реакции называют последовательность и характер стадий реакции. В соответствии с механизмом различают простые и сложные реакции.
Простыми (элементарными) называют реакции, протекающие в одну стадию. К простым реакциям относят диссоциацию большинства двухатомных молекул. Например: Br2 2Br.
Сложные реакции протекают в несколько стадий. Среди сложных реакций различают: конкурирующие, последовательные, сопряженные, обратимые, цепные, фотохимические и др.
1. Конкурирующие реакции можно схематично записать так:
A
B1
![]() X1
X1
A
B2
![]() X2
X2
Например: при нитровании фенола одновременно протекают два процесса – образование орто- и пара-нитрофенола.
2. Последовательные реакции можно записать в виде:
A
![]() B
B
![]() C.
C.
Примером является реакция гидролиза соли, образованной многоосновной кислотой или многокислотным основанием:
Na2CO3 H2O NaHCO3 NaOH; (k1);
NaHCO3 H2O H2CO3 NaOH; (k2).
Биохимические реакции в организме человека в большинстве случаев являются последовательными. Например, глюкоза, поступающая в организм, в процессе окисления превращаясь в пировиноградную кислоту, претерпевает девять последовательных превращений (процесс гликолиза).
3. Сопряженные реакции отвечают общей схеме:
a)
A
B
![]() M;
M;
b)
A
C
![]() N.
N.
При этом реакция (а) может протекать самостоятельно, тогда как реакция (b) протекает только при наличии реакции (а).
4. Обратимые реакции. Большинство реакций в той или иной степени обратимы, поэтому следует учитывать как прямую, так и обратную реакцию:
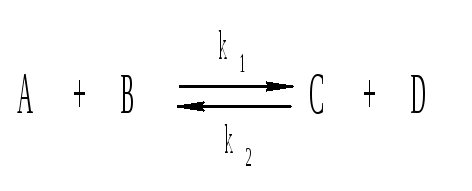
Например, обратимой является реакция образования аммиака:
N2 3H2 ⇄ 2NH3.
Скорость прямой реакции убывает с течением времени, а скорость обратной реакции возрастает до момента выравнивания обеих скоростей, когда наступит состояние подвижного химического равновесия.
Если скорость реакции в прямом направлении значительно превышает скорость обратного процесса, то считают, что реакция протекает практически до конца.
5. Цепные реакции это реакции, протекающие с участием химически активных частиц (свободных атомов и радикалов) и состоящие из большого количества повторяющихся стадий.
Образование свободных радикалов, необходимых для начала цепной реакции, происходит при разрыве связей в молекуле и всегда бывает сопряжено с затратой энергии, которая может быть получена:
а) при поглощении молекулой кванта света:
Br2 ![]() Br•
Br•;
Br•
Br•;
б) при электрическом разряде:
O2 ![]() O•
O•;
O•
O•;
в) под воздействием -, -, -излучений (радиоактивный распад);
г) при использовании внутренней тепловой энергии самой системы.
Радикалы, вследствие своей валентной ненасыщенности и высокой химической активности, существуют лишь очень недолго, но они переводят устойчивые молекулы в активное состояние. Начавшаяся цепная реакция продолжается до тех пор, пока не прореагирует все вещество или пока активные частицы по каким-либо причинам не исчезнут. Роль активных радикалов могут играть атомы водорода, хлора, кислорода и группы: СН3–, –ОН, –SH, С6Н5– и др.
По механизму протекания цепных реакций они делятся на неразветвленные и разветвленные.
К неразветвленным цепным реакциям относятся реакции синтеза HCl(газ); НВr(газ) и другие, протекающие, например, под действием света:
H2
Cl2 ![]() 2HCl(газ).
2HCl(газ).
Примером разветвленной цепной реакции, когда расход одной или нескольких активных частиц приводит к образованию значительно большего количества таких частиц, является реакция горения водорода (рис. 1).
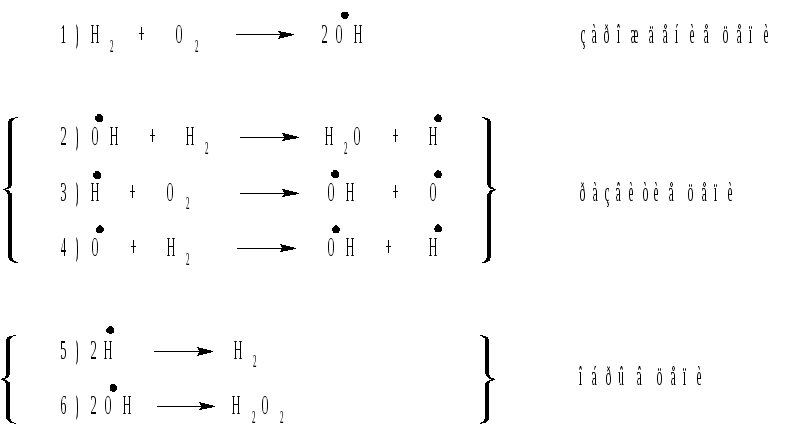
Рис. 1. Схема цепной реакции горения водорода.
Для зарождения
цепи необходима высокая температура.
Особенность
развития
цепи в данной реакции состоит в том, что
поглощение одного радикала
![]() ,
первоначально необходимого для совершения
этой группы реакций, приводит затем к
образованию трех радикалов /
,
первоначально необходимого для совершения
этой группы реакций, приводит затем к
образованию трех радикалов /![]() /.
/.
Актуальным является изучение цепных реакций, возникающих в организме человека при воздействии проникающей радиации, так как образующиеся радикалы способны оказывать воздействие на биологические макромолекулы (ДНК, РНК и др.), что, в свою очередь, вызывает мутации и приводит к наследственным заболеваниям.
6. Фотохимическими называются реакции, которые протекают только при наличии излучения в широком интервале энергий: от видимого и ультрафиолетового до рентгеновского и -лучей.
Энергия активации здесь обеспечивается за счет излучения, под действием которого молекулы исходных веществ переходят в электронно-возбужденное состояние.
Механизмы фотохимических реакций разнообразны. Несмотря на это, во всех случаях можно выделить первичные процессы, непосредственно вызываемые действием света, и вторичные реакции, не требующие освещения для своего протекания и называемые поэтому темными.
К первичным процессам относятся следующие:
1. Возбуждение молекул или атомов, в результате чего образуются менее устойчивые частицы, способные к дальнейшим превращениям:
M
h
![]() M*.
M*.
2. Диссоциация молекул на атомы или радикалы (фотолиз):
AB
h
![]() A
B.
A
B.
3. Ионизация молекул или атомов с выделением электрона (фотоэффект):
M
h
![]() M+
e.
M+
e.
Фотохимические реакции подчиняются следующим законам:
