
Общая химия (дистанционная обучение) / lk8ravn
.doc![]()
Состояние
системы, при котором энтальпийный и
энтропийный факторы уравновешиваются,
т.е. ∆r
GТ
= 0
∆r
GТ
= ∆r
HТ
- T∆r
SТ
= 0
∆r
HТ
= T∆r
SТ
Возможности самопроизвольного протекания прямой и обратной реакции равновероятны.
Парциальные давления и концентрации всех компонентов реакции постоянны во времени и во всех точках системы - равновесные давления и концентрации.
: : При равновесии химической реакции:
aA(г)+bB(г)+
dD(к)![]()
eE(г)+
fF(г)
eE(г)+
fF(г)
изотерма Вант-Гоффа:
.
Δr
GТ
=
∆r
G
0Т
+ RT
ln
 = 0
= 0
………………… ……… …… ……………………………………….
.
∆r
G
0Т
= - RT
ln
 :
:
:
:
pравн. !
: : Если реакция
aA(р-р)+bB(р-р)+dD(к) eE(р-р)+fF(р-р)
протекает в идеальном растворе:
.
.
∆r
G
0Т
= - RT
ln
 :
:
:
:
Математическое выражение закона действующих масс для равновесного состояния:
Кс
=
Кр
=

![]()
![]()
Кс и Кр - константы равновесия,
выраженные через:
Кр Кс
равновесные равновесные .
относительные молярные .
парциальные концентрации
давления расворенных
газов веществ
Р РАВН атм С РАВН моль/л
● ∆r G 0Т = - RT lnКр - для реакций в газовых
системах
..
● ∆r G 0Т = - RT lnКс - для реакций в
конденсированных системах
! R=8,31 Дж /моль.К.
Связь между Кр и Кс через основной закон
Газового состояния:
для каждого газа p = cRT


∆ν = ( e + f) – (a + b) – изменение числа молей газов в результате реакции, ! ! R = 0,082 атм .л/моль.К ю.. !
Выражение Кр - через равновесные количества молей газообразных компонентов ni(равн)
и общее давление P0:
Парциальное
давление конкретного газа - pi
=
![]()
.Кр=![]() =
=![]()
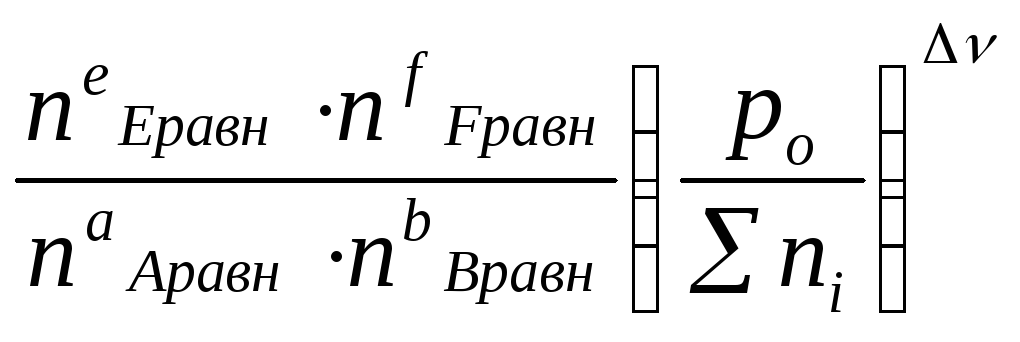 ..
..
Σni = nE равн + nF равн + nA равн + nB равн (для газов !)
……..……………
Кр и Кс - характеризуют
выход продуктов реакции:
чем К тем больше продуктов в равновесной смеси
Кр и Кс не зависят от: !
● парциальных давлений
● концентраций компонентов
● общего давления в системе
Кр и Кс зависят от: !
● природы веществ
● температуры
Зависимость
константы равновесия от температуры
– изобара
Вант-Гоффа:
∆r G0Т = - RTlnКр = ∆r H0 - T∆r S0
lnKp
= -
![]() =
=
![]()
с учетом ≈ ∆r H0 f (T) и ∆r S0 f (T) имеем
▓ уравнение изобары Вант-Гоффа:
![]()
Вывод:
-
если ∆r H0 0 dlnKp/dT 0
Т Кр т.е. с повышением температуры
Кр уменьшается равновесие смещается влево
-
если ∆rH0 0 dlnKp/dT 0
Т Кр т.е. с повышением температуры Кр увеличивается равновесие смещается вправо
Изменение концентраций реагентов
в ходе реакции:
aA(г) +bB(г)+ dD(к) eE( г) +fF(г)
таблица материального баланса:
[моль/л] A (г) B (г) D(к) E (г) F (г)
|
С нач. |
С А |
С В |
- |
С E |
С F
|
|
С прореаг. |
пусть х
|
(b/a)x |
- |
(e/a)x |
(f /a)x |
|
С равн. |
С А - х |
С В - (b/a)x |
- |
С E + (e/a)x |
С F + (f/a)x
|
! Только для самой разбавленной фазы:
к-ж-г ж-г к-ж
г г ж
юКС
=
 ю
ю
юKC
=
 ю
ю
решаем уравнение относительно Х С равн.
для всех реагентов химической реакции.

если
на систему, находящуюся в истинном
равновесии, воздействовать извне,
изменяя какое-либо из условий, определяющих
состояние равновесия, то равновесие
смещается в сторону уменьшения
эффекта внешнего воздействия
Равновесие смещается:
-
при увеличении Т - в сторону.. эндотермической реакции;
-
при увеличении Робщ - в сторону.. образования меньшего числа молей.. газообразных реагентов;
-
при увеличении Рисх веществ - в сторону.. продуктов реакции;
-
при увеличении Сисх веществ - в сторону.. продуктов реакции;
-
при.. увеличении Спродуктов реакции - в сторону.. исходных реагентов.
▼ Задача Для реакции
С(к) + СО2(г) 2СО(г)
Рассчитать Кр и Кс при 298 К и 1000 К. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции.
Решение
:
Кр
=
 ;
:
Кс
=
;
:
Кс
=

: ∆r G0Т = - RTlnКр : Kp = exp(-∆G0Т /RT)
для данной реакции было рассчитано ранее - см. Пример расчета выше:
∆r G0298 = 120,15 кДж; ∆r G01000 = - 3,16 кДж
Кр 298= exp(-120.103/8,31.298) = ехр(-48,5) = 810-22
Kp 1000 =exp(+3160/8,31.1000) = ехр(0,38) = 1, 46
(обратите внимание на размерность!)
Кс
=
![]() =
=
![]() = 0,018
= 0,018
∆ν = 2-1= 1 (изменение числа молей газообр. веществ ! )
-
При 298К - Кр 0 в равновесной смеси практически отсутствуют продукты и смещение равновесия относительно стандартного состояния в сторону исходных веществ, влево.
-
При 1000 К - Кр 1 в равновесной смеси начинают преобладать продукты, их выход растет с увеличением Т, равновесие смещается вправо.
т.к. при Т Кр ∆rH0 0 (с учетом изобары Вант-Гоффа), процесс эндотермический.
▼ Задача Для реакции:
А(г) 2В(г) (Р,Т – const)
Кр1 = 0,02 при 400 К и Кр2 = 4,00 при 600 К.
Определить ∆rH0298 , ∆rS0298 и Кр3 при 800 К.
Решение
Считая, что ∆r H0 f (T) и ∆r S0 f (T) , составим систему из двух уравнений с двумя неизвестными (T1=400 K, T2=600 K):
 ∆rG0Т1
=
∆rH0298
–T1∆rS0298
=
-RT1lnКр1
∆rG0Т1
=
∆rH0298
–T1∆rS0298
=
-RT1lnКр1
∆rG0Т2 = ∆rH0298 –T2∆rS0298 = -RT2lnКр2
 ∆rH0298
– 400∆rS0298
= -
8,31.400
ln2.10-2
∆rH0298
– 400∆rS0298
= -
8,31.400
ln2.10-2
∆rH0298 – 600∆rS0298 = - 8,31.600 ln4
∆rH0298 = 52833(Дж) = 52,833 кДж
∆rS0298 = 99,575 Дж/К
Используем изобару Вант-Гоффа:
ln
![]() = ln
= ln
![]() =
=
![]() (
(![]() )
)
ln
![]() =
ln
=
ln![]() =
=![]() (
(![]() )= 7,95
К800
= 56,55
)= 7,95
К800
= 56,55
при Т Кр ∆rH0 0, процесс эндотермический.
▼ Задача. Определить равновесный состав системы
С(к) + СО2(г) 2СО(г)
Т= 1000 К, Робщ = 2атм, n исх CO2 = 5 моль
Решение. Реакция идет при постоянном давлении Робщ !
Kp =exp(-∆G0Т /RT) , ∆r G01000 = - 3,16 кДж
Kp1000 = exp(+3160/8,31.1000)= ехр(0,38) = 1, 46
Материальный баланс:
|
Компонент |
С |
СО2 |
2СО |
|
Нач. состав, моль |
- |
5 |
0 |
|
Изменение, моль |
- |
х |
2 x |
|
Равновесный, моль |
- |
5 – x |
2 x |
Кр
=
 =
=
 =
=
=
![]() = 1,46
= 1,46
решаем уравнение относительно х х = 1,7 моль
Равновесный состав: n(СО2) = 5 - 1,7=3,3 молей
n(СО) = 21,7 = 3,4 молей
▼ Задача. Определить равновесные концентрации С равн СО2 и СО для реакции
С(к) + СО2(г) 2СО(г)
Т= 1000 К , Vсосудa = 2л, mисх (СО2) = 44г,
Обратите внимание: реакция идет при V=const !
Определить, на сколько изменится давление в системе при равновесии по сравнению с исходным.
Решение
ССО2
=
![]() =
=
![]() = 0,5моль/л;
Кс1000
= 0,018
= 0,5моль/л;
Кс1000
= 0,018
(см.выше)
Таблица материального баланса:
|
Компонент |
С |
СО2 |
2СО |
|
Нач.концентрации, Сисх, моль/л |
- |
0,5 |
0 |
|
Изменение конц.,ΔС, моль/л |
- |
х |
2 x |
|
Равновесные конц., Сравн., моль/л |
- |
0,5 – x |
2 x |
Кс
=
![]() = 0,018
х =
0,0387моль/л
= 0,018
х =
0,0387моль/л
ССО равн = 2. 0,0387 = 0,0774моль/л
ССО2равн = 0,5 - 0,0387 = 0,4613 моль/л
Начальное состояние
Р0 = сRT = 0,5.0,082•1000 = 41атм только СО2
Равновесное состояние
Рравн = ( 0,5-х) + 2х) RT = 44,17 атм СО2 и СО
Изменение давление в системе Р = 3,17 атм
В равновесной системе 3 моля газов:
∑n = 3, nСО2= 1, nСО = 2.
Равновесное парциальное давление газов:
РСО2= 1/3(Рравн) = 14,72 атм, РСО= 2/3(Рравн) = 29,45 атм.
▼ Задача. Предложите способы увеличения выхода продуктов реакции
С(к) + СО2(г) 2СО(г)
Решение. Для повышения выхода продукта СО нужно равновесие сместить вправо.
Для смещения равновесия вправо нужно:
* Т системы, т.к. ∆r H0298 0;
* Рсистемы , т.к. прямая реакция идет с увеличением числа молей газообразных веществ;
* РСО2 ;
* РСО (выводить из сферы реакции).
ОПЫТЫ
СМЕЩЕНИЕ РАВНОВЕСИЯ. «ГЛИКОЛЬ»
CuSO4 + 2NH2CH2COOH Cu(NH2CH2COOH )2+ H2SO4
голубой гликоль синий
цвет цвет
3 цилиндра:
1 – для сравнения
2 – добавляем CuSO4 → синий цв.
3 – добавляем гликоль → синий цв.
4 – добавляем H2SO4 ← голубой цв.
5 – добавляем NаОH → синий цв.
