Химическая
связь
– это такое
взаимодействие между частицами, при
котором образуются новые устойчивые
структуры: молекулы, ионы, радикалы,
комплексы и другие системы.
Условия образования химической связи:









Природа сил химической связи – электрическая.
Квантовая механика позволяет объяснить и описать
образование всех типов химических связей.


Количество
энергии, выделяющееся при образовании
химической связи в расчете на 1 моль
вещества.
Чем больше
энергия химической связи, тем она
прочнее. Молекула
СН4
Есв
= 1640 : 4 = 410 кДж/моль
Есв
~ 300
-
1000
кДж/моль

Межъядерное
расстояние взаимодействующих частиц. Зависит
от размеров электронных оболочек и
степени их перекрывания.
lсв
~ 0,1
–0,3
нм

Число
химических связей между взаимодействующими
частицами
|
молекула |
связь |
Есв, кДж/моль |
lсв, нм |
вывод |
|
F2 |
F – F |
159,0 |
0,142 |
Чем меньше lсв, тем больше Есв и устойчивее молекула |
|
H2 |
H – H |
436,0 |
0,074 | |
|
О2 |
О О |
498,7 |
0,120 |
Чем выше кратность связи, тем больше Есв и устойчивее молекула |
|
N2 |
N N |
945,6 |
0,109 |

Химическая
связь, образованная в результате
обобществления валентных электронов
в области связывания (между ядрами
атомов)
«Ковалентная» - совместно действующая

Зависимость
энергии системы
из 2-х атомов водорода с антипараллельными
(1)
и параллельными (2)
спинами Е
– энергия связи

Существует два основных квантово-механических приближенных методов описания ковалентной связи: метод валентных связей (ВС) и метод молекулярных орбиталей (МО ).

◄химическая связь
- результат перекрывания АО с образованием
связывающих электронных пар (образование
общей пары электронов, образование
повышенной электронной плотности между
атомами);
◄химическая связь
образуется только при взаимодействии
электронов с антипараллельными спинами
(по принципу Паули);
◄связь образуется
в направлении максимального перекрывания
АО реагирующих атомов.







► Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону.
► Донорно-акцепторный механизм - образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
ПРИМЕР: образование иона аммония NН4+ (NН3 + Н+ NН4+)

►Дативные связи – образуются, когда АО одного атома, могут выступать одновременно в роли и донора и акцептора неподеленных пар электронов.
 ПРИМЕР:
образование
молекулы Cl2
ПРИМЕР:
образование
молекулы Cl2
Следствие - энергия связи в молекуле Сl2 ( 243 кДж/моль) выше, чем в молекуле F2 (159 кДж/моль), несмотря на большую длину связи.










Валентный
угол
- это угол между воображаемыми прямыми,
проходящими через ядра химически
связанных атомов







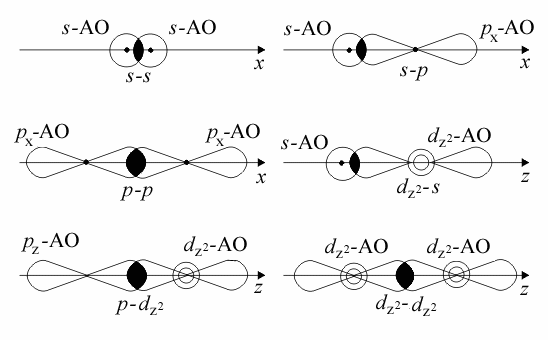
- связь – связь, образуемая по линии, соединяющей центры атомов;
- связь – связь, при которой перекрывание облаков происходит над и под воображаемой линией, соединяющей центры атомов;
δ – связь – связь, образуемая при наложении друг на друга и перекрывании d-облаков в 4-х областях
Перекрывание АО разных типов при образовании
- связей: