- •Химия в энергетическом институте – фундаментальная общетеоретическая дисциплина.
- •М.В.Ломоносов (1741 г.) – “Химическая наука рассматривает свойства и изменения тел…, состав тел…,объясняет причину того, что с телами при химических превращениях происходит”.
- •Тема 1. Электронное строение атома. Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента.
- •1. Главное квантовое число (n):
- •2. Орбитальное квантовое число (l) :
- •3. Магнитное квантовое число (ml)
- •4. Cпиновое квантовое число (ms)
3. Магнитное квантовое число (ml)
-
определяет – значение проекции орбитального момента количества движения электрона на произвольно выделенную ось
-
показывает – пространственную ориентацию АО
-
принимает значения – от –l до + l
 Любому значению l
соответствует (2l+1)
значений магнитного квантового числа,
т.е. (2l+1) возможных
расположений электронного облака
данного типа в пространстве.
Любому значению l
соответствует (2l+1)
значений магнитного квантового числа,
т.е. (2l+1) возможных
расположений электронного облака
данного типа в пространстве.
s-состояние – одна орбиталь (20+1=1) - ml=0, т.к. l=0
p -состояние
– три орбитали (21+1=3)
-состояние
– три орбитали (21+1=3)
ml: +1 0 -1, т.к.l=1
 z ml=1
z ml=0
z ml
= -1
z ml=1
z ml=0
z ml
= -1
Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию и называются вырожденными.
Вывод – АО характеризуется определенным набором n,l,ml, т.е. определенными размерами, формой и ориентацией в пространстве.
4. Cпиновое квантовое число (ms)
-
определяет - собственный механический момент электрона, связанный с вращением его вокруг своей оси
-
п

 ринимает
значения - +1/2 h/2
или –1/2 h/2
ринимает
значения - +1/2 h/2
или –1/2 h/2
В многоэлектронном атоме состояние электрона определяется принципом Паули:
в атоме
не может быть двух электронов, у которых
все четыре квантовых числа были бы
одинаковы.
С
 ледствия
из принципа Паули:
ледствия
из принципа Паули:
-
на одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами
-
максимальное число электронов на энергетическом подуровне – 2(2l+1)
-
максимальное число электронов на энергетическом уровне – 2n2
Электроны в атоме (основное состояние) распределяются в соответствии с принципом минимальной энергии:
Электроны
занимают наиболее низкое энергетическое
состояние, отвечающее наиболее
устойчивому его состоянию.
Правило Клечковского:
Электроны
размещаются последовательно на
орбиталях, характеризуемых возрастанием
суммы главного и орбитального квантовых
чисел (n+l);
при одинаковых значениях этой суммы
раньше заполняется орбиталь с меньшим
значением главного квантового числа
n
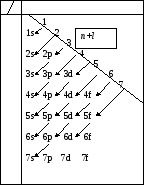
n l 0 1 2 3
1
2
3
4
5
6
7
З
В
пределах энергетического подуровня
электроны располагаются так, чтобы их
суммарный спин был максимальным.
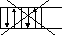
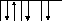
Существует два способа составления схем распределения электронов в атоме:
-
в виде формул электронных конфигураций
19К 1s22s22p63s23p64s1
-
в виде графических формул АО
Е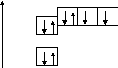 p
p
s
n = 2
8О
s
n = 1
Периодический закон. Периодическая система элементов Д. И. Менделеева.
Периодический закон:
-
формулировка Д.И.Менделеева (1869 г.)
Свойства
простых тел, а также свойства и формы
соединений элементов находятся в
периодической зависимости от величины
атомных весов элементов
-
с
Свойства химических элементов, а также свойства и формы образуемых ими соединений находятся в периодической зависимости от величины заряда их ядер
овременная формулировка
Элементы располагаются в периодической системе в порядке возрастания заряда их ядер.
Ф
за
счет периодически повторяющейся
конфигурации электронных оболочек
атомов происходит периодическое
повторение химических свойств их
элементов
7 периодов; 8 групп; каждая группа из 2-х подгрупп (А и В)
А подгруппа – главная
В подгруппа – побочная
Элементы-аналоги – элементы, имеющие одинаковое строение внешних электронных оболочек и расположенные в одной подгруппе.
В зависимости от того , какой энергетический подуровень заполняется электронами последним, раэличают четыре типа элементов:
-
s-элементы
расположены в 1А, 2А подгруппах и Н,Не
их краткая электронная формула:
ns12
где n –номер периода, в котором находится элемент
-
2) – номер группы, в которой находится элемент
-
р-элементы
расположены в 3А - 8А подгруппах
их краткая электронная формула:
ns2np16
-
d – элементы
расположены в В - подгруппах
их краткая электронная формула:
(n-1)d110ns2(1)
-
– «проскок электронов» Cu,Ag,Au,Pt,Pd,Rh,Ru,Cr,Mo,Nb
-
f – элементы
лантаниды и актин иды
их краткая электронная формула:
(n-2)f114(n-1)d02ns2
ВАЛЕНТНОСТЬ
Способность
атома присоединять или замещать
определенное число других атомов с
образованием химических связей
Количественной мерой валентности - число неспаренных электронов в основном или возбужденном состоянии атома.
возбужденное состояние
расспаривания
(или пар) электронов и переходе одного
из них (или нескольких электронов,
равных числу разъединенных пар) на
свободную орбиталь того же энергетического
уровня
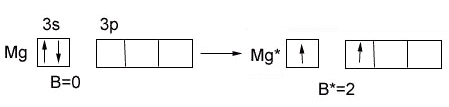 валентность Мg
- в основном состоянии = 0
валентность Мg
- в основном состоянии = 0
в возбужденном состоянии = 2
К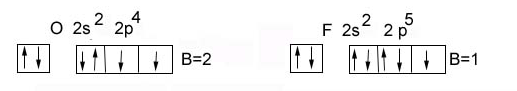 ислород
и фтор – возбужденного состояния нет
ислород
и фтор – возбужденного состояния нет
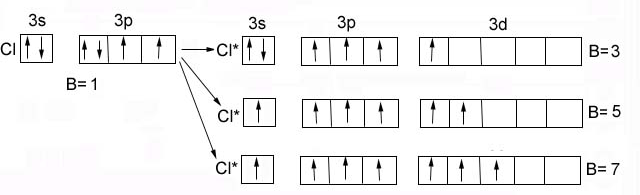
Cl– аналог фтора – валентность 1, 3, 5, 7 - наличие свободных d-орбиталей на третьем энергетическом уровне:
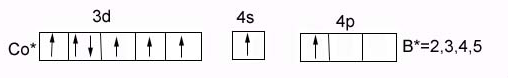
валентность Cо: в основном состоянии = 0
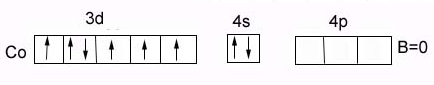
В возбужденном состоянии