
3. Полярность ковалентной связи
неполярная ковалентная связь
связывающая
электронная пара равномерно распределена
между ядрами взаимодействующих атомов
Связь образована атомами с одинаковым значением ЭО ( ЭО = 0): Н2, О2 и т.д.
полярная ковалентная связь
связывающая
электронная пара смещена к атому с
большим значением ЭО
Молекула НСl связывающая электронная пара смещена в сторону Cl: ЭО(Cl) =3,0, ЭО(Н) =2,1 эффективный отрицательный заряд (-q) у атома Cl эффективный положительный заряд (+q) у атома Н электрический диполь.
длина диполя (lД) :
расстояние
между центрами тяжести эффективных
зарядов (+q
и –q)
электрический момент диполя связи св
(количественная мера полярности связи)
произведение
эффективного заряда
q
на длину диполя lд
связи:
св
= qlд.
(Клм)
![]()
![]()
![]()
![]() св
- векторная величина, направленная от
положительного полюса к отрицательному.
св
- векторная величина, направленная от
положительного полюса к отрицательному.
![]()
|
молекула |
ЭО |
св10-30,Клм |
вывод |
|
Н – Сl |
0,90 |
1,03 |
Чем больше ЭО, тем больше св и, следовательно, связь более полярная |
|
Н – Br |
0,74 |
0,78 |
|
|
H I |
0,40 |
0,38 |
ПОЛЯРНОСТЬ МОЛЕКУЛ
электрический момент диполя молекулы (м)
векторная
сумма электрических моментов диполей
всех связей и несвязывающих электронных
пар в молекуле
Полярность молекулы зависит от ее геометрической структуры.
2-х атомные молекулылинейная структура м =св
Если
м
= св
= 0
молекула неполярная Если
м
= св
0
молекула полярная
Молекула Н2S угловая структура( 920)
ЭО(Н)=2,1 и ЭО(S)=2,5) связь полярная.

м = св 0. молекула в целом полярная.
Молекула SbН3
S b…5s25p3
b…5s25p3
Н 1s1 Н 1s1 Н 1s1
 Структура
– тригональная пирамида
Структура
– тригональная пирамида
Связь полярная, т.к. Э.О.0
м = св 0. молекула в целом полярная.
Гибридизация атомных орбиталей.
Если у атома в образовании химических связей участвуют разные по типу АО (s-, p-, d- или f-АО), то химические связи формируются электронами не «чистых», а «смешанных», или гибридных орбиталей.
Гибридизация:
смешение
АО с разными (но близкими) энергетическими
состояниями, вследствие которого
возникает такое же число одинаковых
по форме и энергии орбиталей, симметрично
расположенных в пространстве.
Перекрывание гибридных АО происходит в большей степени, чем негибридных орбиталей химические связи прочнее молекула более устойчива. Гибридная орбиталь:

типы гибридизации АО

|
Орбитали, участвующие в гибридизации |
Тип гибридизации |
Структура молекулы |
Валентный угол |
|
s+p |
sp |
линейная |
180о |
|
s+p+p |
sp2 |
плоский треугольник |
120о |
|
s+p+p+p |
sp3 |
тетраэдр |
109,3о |
Молекула ВеСl2

sp-гибридизация АО Ве , 180о
пространственная структура линейная.
![]()
Cl Be Cl
ЭО Ве и Cl: 1,5 и 3,0 связь полярная св 0
Cl Be Cl
мол = св = 0 молекула в целом неполярная.
Молекула ВН3.
 В
2s1
2p2
В
2s1
2p2
H 1s H 1s H 1s
s-s перекрывание и два p-s перекрывания АО.
sp2–гибридизация
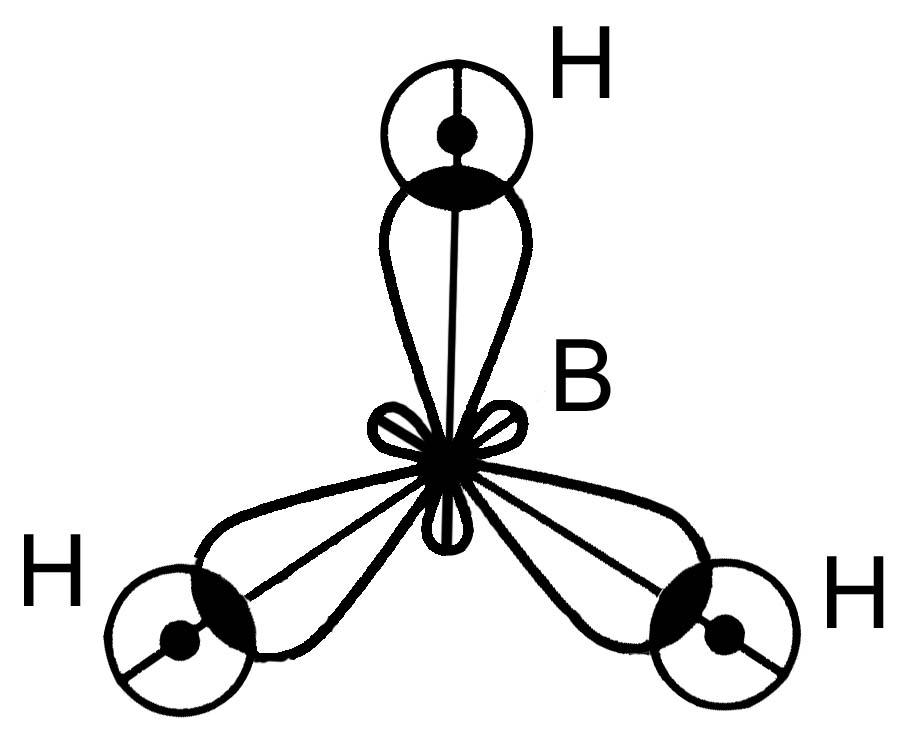

- связи, 120 , связи полярные ЭО = (2.1-2.0) 0. Структура молекулы - плоский треугольник.
мол = св =0 молекула ВН3 - неполярная.
Молекула SiCl4
Si 3s 3p Cl 3s 3p

Cl 3s 3p Cl 3s 3p Cl 3s 3p
одна s-АО и три р-АО sp3- гибридизация АО Пространственная структура молекулы тетраэдр
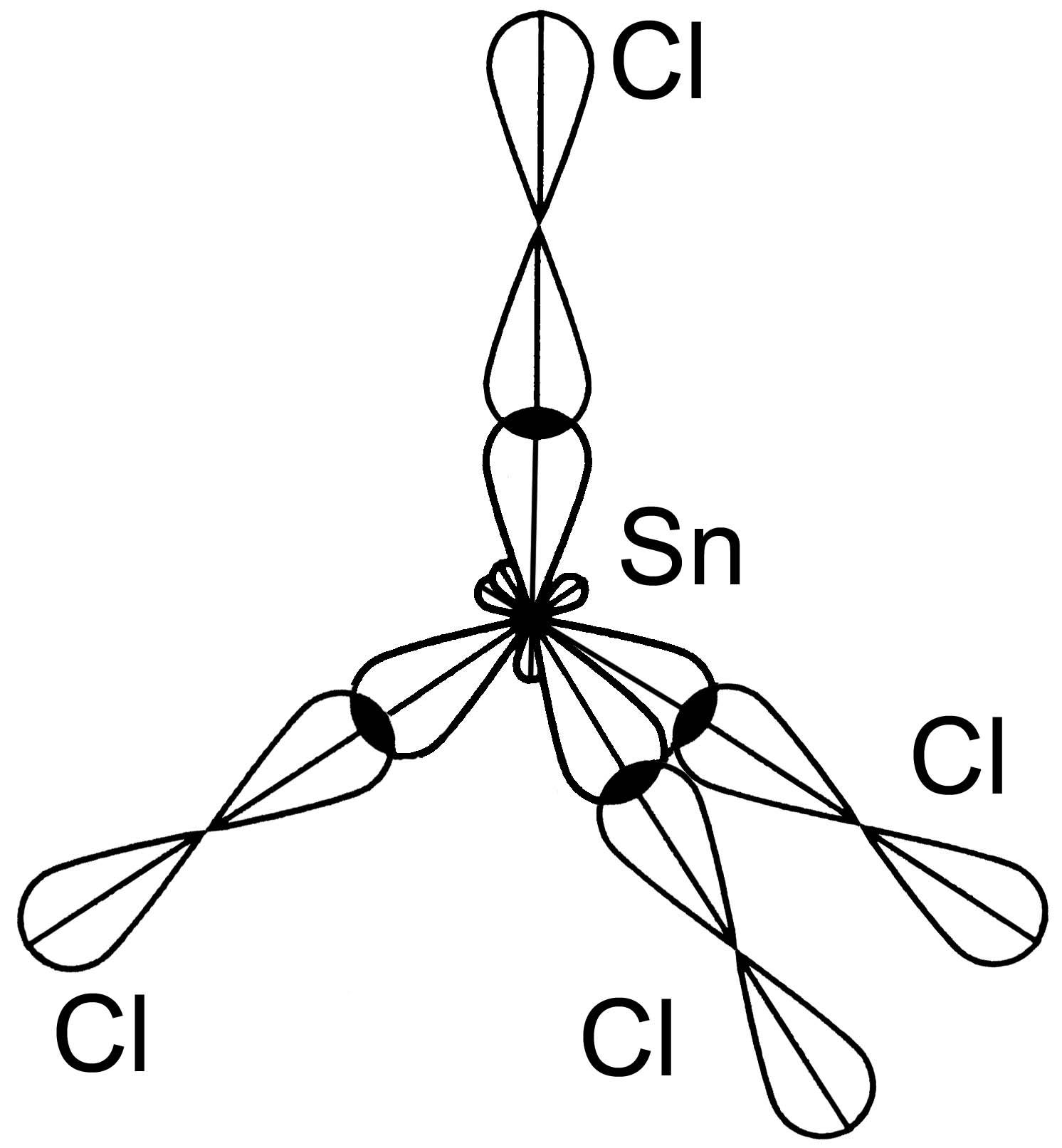
109,30 связи – полярные, ЭО = 3 – 1,8 0.
св=0 - молекула в целом неполярная.
Вывод:
а) если гибридные АО центрального атома взаимодействуют с АО одинаковых атомов, то молекула неполярная ( СН4, ВF3).
б) если гибридные АО взаимодействуют с разными атомами (CH2Cl2,ВF2Cl), то молекулы полярные,
т. к. величины векторов электрических моментов диполей связей отличаются.
Молекулы NН3 и Н2О
N …2s22p3
O…2s22p4
…2s22p3
O…2s22p4

H 1s1 H 1s1 H1s1 1s1 1s1
sp3 – гибридизация АО азота «N» и кислорода «О».

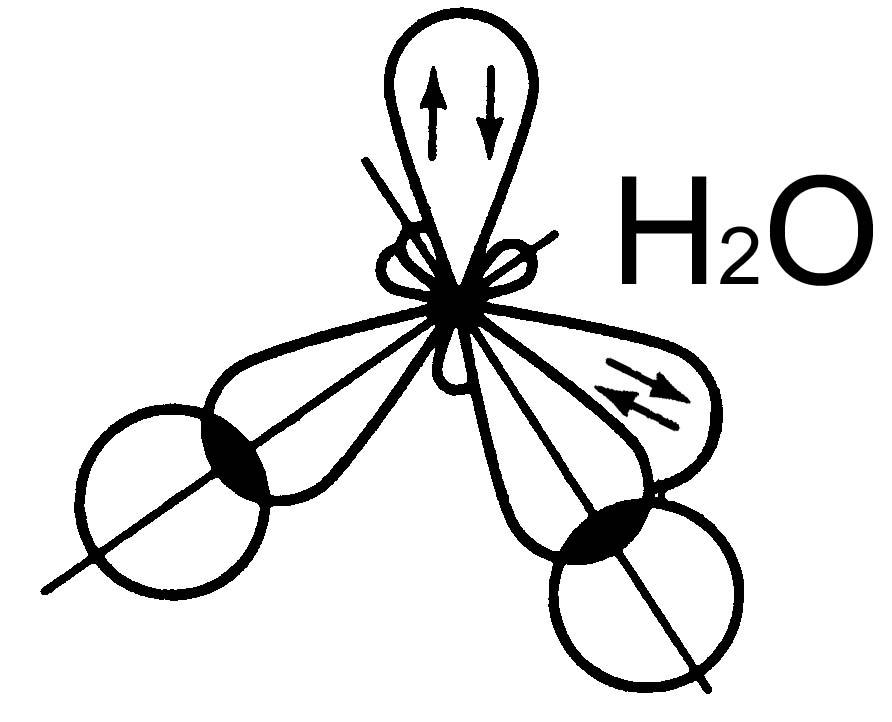
Неподеленные электронные пары (НП) влияют на величину валентных углов силы отталкивания между ними больше, чем между относительно закрепленными электронными парами образующими связь (связывающая электронная пара - СП).
Уменьшение силы отталкивания электронных пар: НП-НП НП-СП СП-СП
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о , а в молекуле Н2О две НП уменьшают его до 104,5о.


