
Тема 2. Химическая связь
Фундаментальной
основой химической связи явилась теория
химического строения А.М. Бутлерова
(1861 г.), согласно которой свойства
соединений зависят от природы и числа
составляющих их частиц и химического
строения.![]()
Химическая связь
различные
виды взаимодействий между электронами
и ядрами, приводящие к соединению
атомов в новые устойчивые структуры:
молекулы, ионы, радикалы, кристаллические
и другие вещества
Условие образования химической связи:
-
снижение общей энергии многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована (при образовании вещества АВ из атомов А и В ЕАВ ЕА + ЕВ )
-
перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
Основные типы химической связи
(разное распределения электронной плотности между




 ядрами)
ядрами)
ковалентная ионная металлическая водородная
межмолекулярная
Основные параметры химической связи
Энергия связи Есв , кДж/моль
Количество
энергии, выделяющееся при образовании
химической связи и характеризующее ее
прочность
Молекула СН4 Есв = 1640 : 4 = 410 кДж/моль).
Чем больше энергия химической связи, тем устойчивее молекулы
Длина связи lсв ,нм
Межъядерное
расстояние взаимодействующих атомов
Она зависит от размеров электронных оболочек и степени их перекрывания.
Кратность связи
Кол-во
связей между взаимодействующими атомами
|
молекула |
связь |
Есв, кДж /моль |
lсв, нм |
вывод |
|
F2 |
F - F |
159,0 |
0,142 |
Чем меньше lсв, тем больше Есв и устойчивее молекула |
|
H2 |
H – H |
436,0 |
0,074 |
|
|
О2 |
О О |
498,7 |
0,120 |
Чем выше кратность связи, тем больше Есв и устойчивее молекула |
|
N2 |
N N |
945,6 |
0,109 |
|
Связь
|
ЕСВ КДж/моль |
LСВ нм |
|
Связь
|
ЕСВ КДж/моль |
LСВ нм |
|
H-F
H-Cl
H-Br H-I H-H H-S |
536
432
360 299 436 380 |
0.092
0.128
0.142 0.162 0.074 0.134 |
|
C-C
C=C
O=O -CC- CO NN |
348
614
495 839 1040 940 |
0.154
0.134
0.121 0.120 0.113 0.110 |
Угол связи или валентный угол
Угол
между воображаемыми прямыми, проходящими
через ядра химически связанных атомов
 В
молекуле Н2О
длина связи Н-О равна 0,096 нм, угол связи
НОН – 104,5, а энергия связи Ено
= 464 кДж/моль.
В
молекуле Н2О
длина связи Н-О равна 0,096 нм, угол связи
НОН – 104,5, а энергия связи Ено
= 464 кДж/моль.
КОВАЛЕНТНАЯ СВЯЗЬ
Химическая
связь, образованная в результате
обобществления валентных электронов
в области связывания (между ядрами
атомов)
«Ковалентная» - совместно действующая
Существует два квантово-механических подхода к описанию ковалентной связи: метод валентных связей (ВС) и метод молекулярных орбиталей (МО ).
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ.
1927 г. нем.уч. У. Гейтлер и Ф.Лондон
Н + Н = Н2
квантово-механический расчет взаимодействия атомов водорода.
 Из
уравнения Шредингера
Есист= f (r
), где r- расстояния
между ядрами атомов водорода.
Из
уравнения Шредингера
Есист= f (r
), где r- расстояния
между ядрами атомов водорода.
1) При сближении двух атомов



 +
+
электроны с антипараллельными спинами притягиваются одновременно двумя протонами- Fпритяжения
Два электрона отталкиваются друг от друга, то же наблюдается и для двух протонов - Fотталкивания
Fпритяжения Fотталкивания Есист - уменьшается (кр.1).
При некотором расстоянии между ядрами (r = lсв) Есист= min - система наиболее устойчива химическая связь Н2.
Б) При сближении атомов, у электронов которых спины параллельны Fпритяжения Fотталкивания Есист возрастает (кр.2).
Основные положения метода ВС
а) химическая связь - перекрывания АО с образованием связывающих электронных пар (обобществление двух электронов);
б) химическая связь - взаимодействии электронов с антипараллельными спинами (по принципу Паули);
в) связь направлена в сторону максимального перекрывания АО реагирующих атомов.
г) характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО;
Механизм образования ковалентной связи


обменный донорно-акцепторный дативный
Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону.
Донорно-акцепторный механизм - образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Ион аммония NН4+ (NН3 + Н+ NН4+)

Дативные связи – образуются, когда АО, могут выступать одновременно в роли и донора и акцептора неподеленных пар электронов.
Образованте молекулы Cl2
 Энергия
связи в молекуле Сl2
( 243 кДж/моль) выше, чем в молекуле F2
(159 кДж/моль), несмотря на большую длину
связи.
Энергия
связи в молекуле Сl2
( 243 кДж/моль) выше, чем в молекуле F2
(159 кДж/моль), несмотря на большую длину
связи.
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
1.Насыщаемость ковалентной связи - запрещается (по принципу Паули) использование одной и той же орбитали дважды для образования связи.
2.Направленность ковалентной связи - АО пространственно ориентированы вокруг ядра атома перекрывание АО происходит по определенным направлениям пространственная структура молекул. Количественно направленность - значение валентных углов.
Молекула NaI
3s -АО атома Na перекрываются с 5p – АО атома иода, имеющими по одному неспаренному электрону:
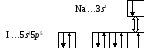

s-p
-перекрывание
Механизм образования связи - обменный.
Связь называется - - связь:
связь,
находящаяся на воображаемой линии,
соединяющей ядра взаимодействующих
атомов
Валентный угол 180о, структура молекулы - линейная
Молекула оксида углерода (II) СО.
Между атомами углерода и кислорода образуются три связи: две по обменному механизму

и одна по донорно-акцепторному механизму:
‘O’ - донор, атом ‘C’- акцептор.
Три ковалентные связи образуются за счет перекрывания трех р-АО каждого атома.
Структура молекулы – линейная.

Одна связь - связь, а две другие - -связи:
связь,
при которой перекрывание АО находится
под углом к воображаемой линии,
соединяющей ядра взаимодействующих
атомов
Перекрывание АО при образовании -связей меньше (Есв-меньше), чем при -связях, поэтому -связи менее прочные.
Молекула Н2S
структура – угловая, валентный угол –92о

Почему валентный угол в ряду молекул: H2S (92o), Н2Se (91o) и Н2Те (89о) изменяется?
S, Se и Te - электронные аналоги : S 3s23р4
Se 4s24p4
Te 5s25p4
Пространственная конфигурация всех молекул – угловая. Причина изменения валентного угла увеличение размера атома увеличение расстояния между связывающими электронными парами уменьшение силы отталкивания между ними уменьшение валентного угла.
