
- •Вопрос 32. Адиабатный процесс, уравнение Пуассона. Работа газа в адиабатичδ процессе.
- •Вопрос 33. Круговые процессы (циклы). Кпд тепловой машины. Цикл Карно и его термический кпд.
- •Вопрос 34. Обратный цикл Карно. Холодильная машина.
- •Вопрос 35.Обратимые и необратимые процессы. Второе начало термодинамики и его формулировки.
- •Вопрос 36.Энтропия. Энтропия и законы термодинамики. Примеры вычисления энтропии.
- •Вопрос 37. Реальные газы. Отступление от законов идеальных газов. Взаимодействие молекул. Уравнение Ван-дер-Ваальса. Анализ уравнения Ван-дер-Ваальса.
- •Вопрос 38. Уравнение Ван-дер-Ваальса и сопоставление его с опытом. Критическое состояние. Связь между критическими параметрами. Внутренняя энергия реального газа.
- •Вопрос 40. Колебания и характеризующие их величины. Собственные колебания. Колебаниями называются движения или процессы, которые характеризуются определённой повторяемостью во времени.
- •Вопрос 41. Гармоническое колебательное движение. Общий признак колебаний. Дифференц уравнение гармонических колебаний. Энергия гармонич колеб.
- •Вопрос 42. Физический и математический маятники. Периоды их колебаний. Приведенная длина физического маятника.
- •Вопрос 44. Выужденные колебания. Диифференц ур-е и его решение. Резонанс и его условия.
- •Вопрос 46. Образование вол в упругой среде. Продольные и поперечные волны. Уравнение плоской волны. Фазовая скорость. Принцип суперпозиции. Стоячие волны.
Вопрос 36.Энтропия. Энтропия и законы термодинамики. Примеры вычисления энтропии.
![]() -
обратимый
цикл;
-
обратимый
цикл;
![]() -
необратимый цикл }=> интегралы Клазиуса
и являются математической записью 2 Н
т/д. Интегралы Клазиуса не зависят от
того каким путем мы переводим систему
из одного состояния в другое а выражениеδQ/T
– является полным дифференциалом
некоторой функции S
являющийся функцией состояния. Эту
функция назвали энтропией.
Энтропия,
функция состояния S термодинамической
системы, изменение которой dS для
бесконечно малого обратимого изменения
состояния системы равно отношению
количества теплоты
-
необратимый цикл }=> интегралы Клазиуса
и являются математической записью 2 Н
т/д. Интегралы Клазиуса не зависят от
того каким путем мы переводим систему
из одного состояния в другое а выражениеδQ/T
– является полным дифференциалом
некоторой функции S
являющийся функцией состояния. Эту
функция назвали энтропией.
Энтропия,
функция состояния S термодинамической
системы, изменение которой dS для
бесконечно малого обратимого изменения
состояния системы равно отношению
количества теплоты ![]() полученного
системой в этом процессе (или отнятого
от системы), к абсолютной температуре Т:
dS=δQ/T.
1/T
– интегральный множитель для δQ.
[S]=
Дж/К. Поскольку dS=
δQ/T,
a
δQ
– алгебраическая величина, то изменения
энтропии dS
зависит от того какой знак имеет δQ.
δQ>0,
dS>0
– энтропия возврастает, δQ<0
,dS<0-убывает,
δQ=0
– адиабатный процесс, то dS
=0 – энтропия не изменяется. Энтропия
обладает свойством аддитивности:
энтропия всей системы состоит из
нескольких частей равных сумме энтропийных
частей этой системы. Если система
изолирована и не получает тепло извне
δQ=0,
то S2-S1>0
- энтропия изолированной системы в
которой протекают необратимые процессы
возрастает. Изолированной назыв система
окруженная жесткой адиабатной оболочкой
(жесткой – не позволяет совершать работу
над системой, адиабатной – препятствует
охлаждению). Если в изолированной системе
протекает только обратимые процессы
то
полученного
системой в этом процессе (или отнятого
от системы), к абсолютной температуре Т:
dS=δQ/T.
1/T
– интегральный множитель для δQ.
[S]=
Дж/К. Поскольку dS=
δQ/T,
a
δQ
– алгебраическая величина, то изменения
энтропии dS
зависит от того какой знак имеет δQ.
δQ>0,
dS>0
– энтропия возврастает, δQ<0
,dS<0-убывает,
δQ=0
– адиабатный процесс, то dS
=0 – энтропия не изменяется. Энтропия
обладает свойством аддитивности:
энтропия всей системы состоит из
нескольких частей равных сумме энтропийных
частей этой системы. Если система
изолирована и не получает тепло извне
δQ=0,
то S2-S1>0
- энтропия изолированной системы в
которой протекают необратимые процессы
возрастает. Изолированной назыв система
окруженная жесткой адиабатной оболочкой
(жесткой – не позволяет совершать работу
над системой, адиабатной – препятствует
охлаждению). Если в изолированной системе
протекает только обратимые процессы
то
 ,S=const
– энтропия изолированной системы в
которой протекает обратный процесс
остается неизменный. Энтропия изолированной
системы при любых процессах протекающих
в ней не убывает. Поскольку все реальные
процессы являются необратимыми то в
изолированной системе они сопровождаются
ростом энтропии. Энергия изолированной
системы (И.С.) постоянная, то энтропия
не может служить показателем того в
каком направлении протекает процесс в
этой системе. В конечном состоянии в
И.С. энтропия всегда не меньше чем
начальном. По изменению энтропии мы
можем сказать в каком направлении
протекает процесс. Энтропия возрастает
до определенного значения. Закон
возрастания энтропии в И.С.: энтропия
И.С. стремится к максимуму. Примеры
вычисления энтропии: 1
Н Т/Д:
,S=const
– энтропия изолированной системы в
которой протекает обратный процесс
остается неизменный. Энтропия изолированной
системы при любых процессах протекающих
в ней не убывает. Поскольку все реальные
процессы являются необратимыми то в
изолированной системе они сопровождаются
ростом энтропии. Энергия изолированной
системы (И.С.) постоянная, то энтропия
не может служить показателем того в
каком направлении протекает процесс в
этой системе. В конечном состоянии в
И.С. энтропия всегда не меньше чем
начальном. По изменению энтропии мы
можем сказать в каком направлении
протекает процесс. Энтропия возрастает
до определенного значения. Закон
возрастания энтропии в И.С.: энтропия
И.С. стремится к максимуму. Примеры
вычисления энтропии: 1
Н Т/Д:
![]() |=>
|=>
![]() |=>
|=>![]() -
обобщенная математическая запись 1 Н
Т/Д и 2 Н Т/Д – основное уравнение
термодинамики.
-
обобщенная математическая запись 1 Н
Т/Д и 2 Н Т/Д – основное уравнение
термодинамики.

1. Изменение энтропии
идеального газа при переходе из 1-2:
 -
изменение энтропииv-молекул
идеального газа при переходе из 1-2.
-
изменение энтропииv-молекул
идеального газа при переходе из 1-2.
1) V=const.
 2) T=const.
2) T=const.
3) p=const

2. Изменение энтропии при плавлении. При p= const – плавление происходит при T=const.
![]() .
Приведенные примеры вычисления энтропии
показывают что по изменению энтропии
можно судить о направлении протекающих
процессов.
.
Приведенные примеры вычисления энтропии
показывают что по изменению энтропии
можно судить о направлении протекающих
процессов.
Вопрос 37. Реальные газы. Отступление от законов идеальных газов. Взаимодействие молекул. Уравнение Ван-дер-Ваальса. Анализ уравнения Ван-дер-Ваальса.
Как известно,
уравнение состояния устанавливает
функциональную связь между давлением p,
объемом V,
температурой T и
числом молей n газа
в состоянии равновесия. Эта связь может
выражаться не только в форме уравнения,
но также графически или в виде таблиц,
которые часто используются, особенно
для практических целей. Самым простым
и известным уравнением состояния
является уравнение состояния идеального
газа: pV = nRT -
где R –
универсальная газовая постоянная.
Реальные газы описываются уравнением
состояния идеального газа только
приближенно, и отклонения от идеального
поведения становятся заметными при
высоких давлениях и низких температурах,
особенно когда газ близок к конденсации.
Причинами
этого являются: 1)собственное размножение
молекул; 2)сила взаимодействия между
молекулами. В реальных газах молекулы
взаимодействуют и эти силы взаимодействия
сильно зависят от расстояния между
молекулами. На расстоянии больше чем
![]() см
силы взаимодействия малы. Между молекулами
одновременно действует и силы притяжения
и силы отталкивания которые меняются
в зависимости от расстояния между
молекулами. При малых расстояниях
преобладают силы отталкивания, при
больших расстояниях – силы притяжения.
По мере сближения молекул начинают
преобладать как силы притяжения, так и
силы отталкивания только с разными
скоростями.
см
силы взаимодействия малы. Между молекулами
одновременно действует и силы притяжения
и силы отталкивания которые меняются
в зависимости от расстояния между
молекулами. При малых расстояниях
преобладают силы отталкивания, при
больших расстояниях – силы притяжения.
По мере сближения молекул начинают
преобладать как силы притяжения, так и
силы отталкивания только с разными
скоростями.
 -
некоторое
состояние- эффективный диаметр молекулы.
при r>r0-силы
притяжения и проекции результирующей
силы ниже
Or.
При приближении второй молекулы к первой
Δr<0-эта
результирующая сила совершает
положит
работу. Так как работу в З.С.
равна изменению потенциальной
-
некоторое
состояние- эффективный диаметр молекулы.
при r>r0-силы
притяжения и проекции результирующей
силы ниже
Or.
При приближении второй молекулы к первой
Δr<0-эта
результирующая сила совершает
положит
работу. Так как работу в З.С.
равна изменению потенциальной
энергии со знаком
минус, то при r>r0,
 -
системы будет отрицат.
-
системы будет отрицат.
На расстоянии
![]() и результирующая этих сил равна 0,при
этом
и результирующая этих сил равна 0,при
этом
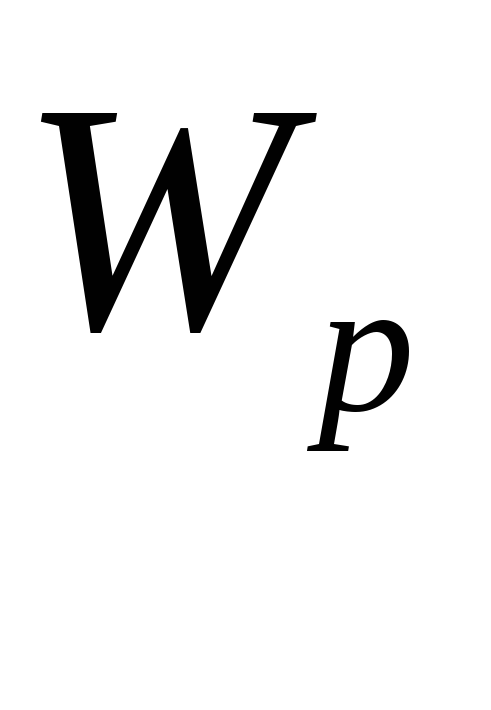 -
минимальна, а кинетическая максимальна.
С уменьшением расстояния
-
минимальна, а кинетическая максимальна.
С уменьшением расстояния
![]() будут возрастать быстрее чем
будут возрастать быстрее чем![]() и силы отталкивания совершать отрицательную
работу. Кинетическая убывает, потенциальная
возрастает. Используя модель голландского
ученого Ван-дер-Ваальс предложил
уравнение состояния для 1 моля реального
газа которое носи его имя.
и силы отталкивания совершать отрицательную
работу. Кинетическая убывает, потенциальная
возрастает. Используя модель голландского
ученого Ван-дер-Ваальс предложил
уравнение состояния для 1 моля реального
газа которое носи его имя.
![]()
![]() -
поправка на силы взаимодействия.
b-поправка
на собственное размножение молекул.
-
поправка на силы взаимодействия.
b-поправка
на собственное размножение молекул.
Это уравнение
лучше описывает состояние газа чем
уравнение Клайперона.
![]()
