
химия+ информатика / Тема 6 Кинетика
.pdf
Реакционная способность химической системы при заданных условиях
Термодинамический фактор Кинетический фактор
2Н2(г) + О2(г) = 2Н2О(ж); rG о298 = -228,61 кДж
Термодинамический критерий ( rG оТ 0)
самопроизвольного протекания процесса – необходимое условие, но недостаточное.
Кинетическим критерием реакционной способности системы является скорость реакции.
- изучает механизм протекания процесса, т.е.
промежуточные стадии, через которые система переходит из начального в конечное состояние, скорости этих стадий, факторы, влияющие на их скорость.
Скорость реакции -
количество вещества, образующееся в единице реакционного объѐма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции) в единицу времени
|
1 |
|
dni |
; |
|
1 |
|
dni |
|
V |
d |
S |
d |
||||||
|
|
|
|
||||||
|
|
|
|
|
V – объѐм реакционной зоны;
S - поверхность раздела фаз; - время
ni – количество i – го исходного вещества.
Если V=const во время реакции: |
Ci |
|
ni |
|||||
V |
||||||||
|
|
|
|
|
|
|
||
|
dCi |
моль |
|
|
||||
d |
|
|
|
|
|
|
||
|
|
|
|
|||||
|
|
л с |
|
|
||||
dCi |
- для исходных веществ - отрицательна |
dCi |
||
d |
d |
|||
dCi |
- для продуктов – положительная |
dCi |
|
|
d |
d |
|
||
Cкорость реакции зависит от:
1)природы реагирующих веществ,
2)концентрации или давления реагирующих веществ,
3)температуры
4)катализатора

Влияние концентрации на скорость реакции
По теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для протекания реакции: A + B→ K + L необходимо:
одновременное нахождение А и В в определѐнной точке реакционного пространства;
удачное их столкновение Вероятность (ω) нахождения молекулы для каждого из
веществ прямо пропорциональна |
его концентрации: |
|
|||
ω = α Cа , |
ω = β C в |
. |
|
||
A |
A |
B |
B |
|
|
Вероятность |
одновременного нахождения |
обеих |
|||
молекул |
в одной |
точке |
пространства, т.е. |
их |
|
столкновения: |
|
|
|
|
|
ω= ωA ωB = α Cа A β Cв B.
γ– доля удачных столкновений
С a A Cb B
C a A Cb B
- основное кинетическое уравнение, закон действия масс, закон Гульдберга Вааге (1864г).
k - константа скорости: а) не зависит от концентрации
б) зависит от температуры и природы реагирующих веществ.
k – удельная скорость k , если СА = СВ = 1моль/л
а,в – частные порядки реакции по веществам А и В
(определяются экспериментально)

n = (а + в) – общий порядок реакции
Впростых (элементарных актах) реакциях: n = 1, 2 редко 3.
Всложных реакциях:n = 0, целочисленные, дробные, (-),(+)
Молекулярность:
Число молекул, участвующих в элементарном химическом акте
Целое (+) число: 1,2, реже 3
1 – мономолекулярные: I2 2I
2 – бимолекулярные: H2 + I2 2HI
3 – тримолекулярные: 2NO + Cl2 2NOCl
а) H2 + I2 2HI – простая (элементарная) реакция n(Н2) = 1, n(I2) =1 ,т.е. равны стехиометрическим коэффициентам.
n = 1+1 =2 |
kCH2 |
CI2 |
б) 2N2O5 O2 + 2N2 O4 - сложная реакция протекает по стадиям:
1.N2O5 O2 + N2O3;
2.N2O3 NO + NO2;
3.2NO2 N2O4 .
исамая медленная стадия – (2) она определяет порядок
кинетического уравнения:
|
|
|
|
dCN O |
kC |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
2 5 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
d |
|
|
|
N O |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
2 |
|
5 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Опыт: 5Na SO + 2HJO |
|
J |
|
|
+ 5Na SO + H O |
|||||||||||||||
|
|
|
|
|
|
|
крахмал |
|
|
|
|
|
|
|
|
|
|
|||
|
2 |
3 |
|
|
|
3 |
|
|
|
|
|
2 |
|
|
|
|
2 |
4 |
2 |
|
x |
|
|
y |
|
|
1 |
2 |
|
2 |
|
1 |
|
2 |
|
|
|||||
1 kC |
Na2 SO3 C |
HJO3 |
|
; |
|
|
|
|
; |
|
|
|
|
|
|
|
|
|||
|
2 |
1 |
2 |
1 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
||

|
k 1,4x |
C x Na |
SO |
1,4y C y HJO |
|
|
2 |
|
2 |
3 |
3 |
|
|
2 |
1,4x y 2 ; |
|
(x+y)lg1,4 = lg2; x+y = |
0,3 |
2 |
|
1 |
|
0,146 |
||||
|
|
|
|
|
||
Лаб.раб.: Na2S2O3 +H2SO4 = S + H2SO3 + Na2SO4 Механизм: 1ст.: Na2S2O3 +H2SO4 = H2S2O3 + Na2SO4 быстро
2ст.: H2S2O3 = S + H2SO3 - медленно
Реакции 1-ого порядка
А  В CH3OCH3 CH4 + H2 + CO
В CH3OCH3 CH4 + H2 + CO
Кинетическое уравнение реакции первого порядка
dC kC . d
Разделим переменные и проинтегрируем
c |
|
|
|
|
|
dc |
k d |
||
|
||||
c0 |
c |
|
0 |
|
|
|
|||
lnC – lnC0 = -k |
|
lnC = lnC0 - k |
||
С0 – исходная концентрация С - концентрация в момент времени
lg C |
k |
lg C0 |
||
|
|
|||
2,303 |
||||
|
|
|||
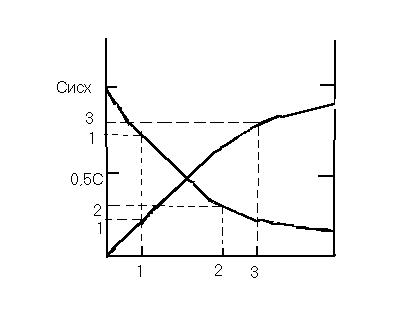
Кинетическая кривая реакций 1-ого порядка
lgC
|
|
|
|
tg = - |
k |
lgCo |
|
|
|
|
|
|
|
|
2.303 |
||
|
|
|
|
|
|
, с

k |
|
1 |
ln |
C0 |
|
k |
2.303 |
lg |
C0 |
k = с-1 |
||
|
|
C |
или |
|
|
C |
. |
|||||
C C0 e k .
период полупревращения τ1/2:
время, за которое прореагировала половина исходного количества вещества
|
|
|
|
k |
|
1 |
|
ln |
|
C0 |
|
||
C = 0,5C0 |
|
1/ 2 |
|
|
1 |
C0 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
1/ 2 |
|
ln 2 |
|
0,693 |
|
|
- не зависит от Со |
||||||
k |
k |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Реакции 2-ого порядка
A + B → продукты |
|
|
или |
|
2А продукты |
|||||||||||||
|
|
kCACB |
|
|
|
|
||||||||||||
пусть C0A = C0B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dc |
|
kC2 |
|
|
|
|
|||||||
|
|
|
d |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
разделим переменные и проинтегрируем: |
||||||||||||||||||
|
|
|
|
C |
|
dC |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
kd |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
C |
2 |
|
|
|
|
|
|||||||||
|
|
|
|
Co |
|
|
|
0 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
1 |
|
|
1 |
|
k |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
С |
|
|
|
|
C0 |
|
|
|
|
||||
k |
|
1 |
|
C0 C |
. |
|
|
|
|
л моль |
-1 |
с |
-1 |
|
||||
|
|
C C0 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Кинетическая кривая реакций 2-ого порядка
1 k 1
С C0
1/C
|
tg = k |
1/C0
Период полупревращения для реакций 2-ого порядка
C = ½ C0
k |
1 |
, |
|
|
|
|
|
1 |
. |
|
|
|
|
|
|
|||
1/ 2 C0 |
1/ 2 |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
kC0 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
½ - обратно пропорционально начальной С0 |
|
|
|
|
||||||||||||||
Реакции 0-ого – порядка: С = С0 - k ; |
1/2 = С0 /2k |
|
|
|||||||||||||||
|
|
1 |
|
|
|
|
1 |
|
|
|
3 |
1 |
|
|
||||
Реакции 3-его порядка: |
|
|
|
|
|
|
2k ; 1 / 2 |
|
|
|
|
. |
||||||
|
|
|
|
|
|
2 |
kC0 |
2 |
||||||||||
C 2 |
|
C0 |
2 |
|
||||||||||||||
Методы определения порядка реакции
Химические реакции - через элементарные стадии, поэтому n определяют экспериментально.
Эксперимент: измеряют Среагир.веществ = f ( ) Обрабатывают полученные данные кинетических
исследований на основании решения кинетического уравнения : – dC/d = kCn:
1)подставляют в константу скорости реакций 1, 2 и т.д. порядков.
Критерий - постоянство k.
2)строят графики:
В зависимости от порядка реакции линейными являются графики в различных координатах
|
|
Таблица |
Порядок |
Кинетическое |
Координаты, в которых |
реакции |
уравнение |
график зависимости С( ) |
|
|
линеен |
0 |
– dC/d = k |
С - |
1 |
– dC/d = kC |
ln С - |
2 |
– dC/d = kC2 |
1/C - |
n |
– dC/d = kCn |
1/Cn-1 - |
Константу скорости можно определить как аналитически (см. выше), так и графически – по величине наклона этих прямых на графиках в соответствующих координатах.
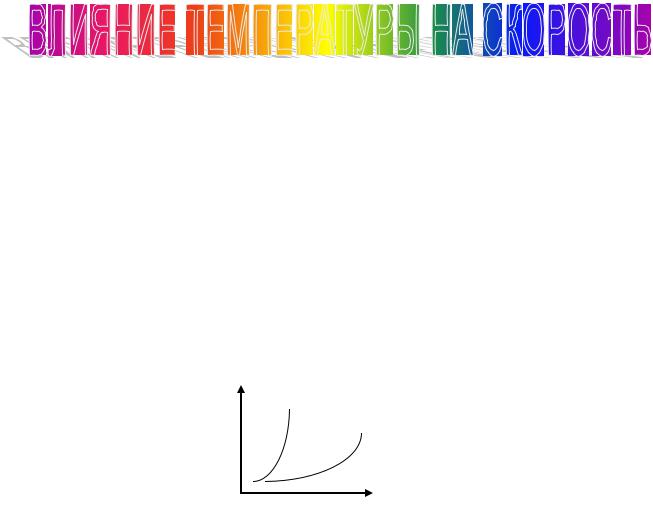
Правило Вант-Гоффа
|
При увеличении температуры на 100 скорость |
|||||
|
реакции возрастает в 2 – 5 раз |
|||||
|
|
|||||
γ = (2-5) - температурный коэффициент |
||||||
|
T |
kT |
T |
|||
|
|
|||||
|
|
|
2 |
|
2 |
10 |
|
|
|
k |
|||
|
T |
|
||||
|
|
|
T |
|
||
|
|
|
1 |
|
1 |
|
(для приблизительных расчѐтов).
экзотерм. эндотерм. v
rН 0
rН 0
Т
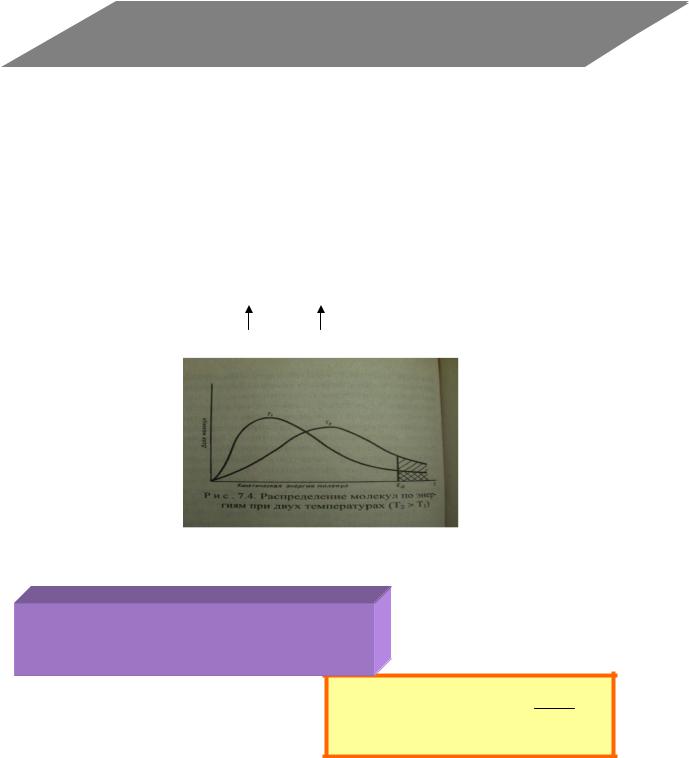
К реакции приводит столкновение лишь тех молекул, энергия которых больше определѐнной величины Ea.
Энергия активации Ea (кДж/моль): |
|
|
|
||||||
разность между средней |
энергией молекул, |
||||||||
способных к активным столкновениям, и средней |
|||||||||
энергией всех молекул |
|
|
|
|
|
|
|
||
По распределению Максвелла-Больцмана: |
|
|
|
||||||
число активных молекул N : |
N |
a |
N eEa / RT |
||||||
|
|
a |
|
|
|
|
|
||
если Т = 300К, Еа = 100483 Дж/моль |
|
|
|
|
|||||
|
N a |
e 100483/ 8,31300 e 40 |
4 10 18 |
|
4 |
|
|||
|
|
1018 |
|
||||||
|
N |
|
|
|
|
|
|||
на 1018 молекул - только 4 молекулы активные
Еа определяется природой реагирующих молекул
Еа не является f(T) – с Т доля активных молекул
Источник активации: тепловая или электрическая энергия, hv, радиоактивность, рентген.
Уравнение С. Аррениуса
(1889г.)
Ea
k k0 e RT ,

k0 – предэкспоненциальный множитель, не зависит от Т физич. смысл: k0 = k, если Еа = 0
Кроме Еа для осуществления реакции необходима благоприятная ориентация молекул в момент
столкновения - стерический фактор.
неблагоприятная ориентация |
благоприятная ориентация |
Вероятность надлежащей ориентации при столкновении
характеризуется энтропией активации
Sакт = RlnW W = eSa/R k0 = Z W
ko = Z eSa/R
Z- общее число соударений в единице объема за единицу времени.
k= ko eEa/RT = Z eSa/R eEa/RT
= kCa A CbB = Z eSa/R eEa/RT Ca A CbB
Определение Еа:
▒ строят график зависимости в координатах (lg k, 1/T).
ln k ln k |
|
|
|
|
Ea |
|||
0 |
RT |
|||||||
|
|
|
|
|
|
|||
|
lg k lg k |
0 |
|
|
Ea |
|
|
|
или |
|
2,303RT |
||||||
|
|
|
||||||
|
|
|
|
|||||
