
химия+ информатика / Тема2 ПСХЭ
.pdf
Периодический закон. Периодическая система элементов Д. И. Менделеева.
формулировка Д.И.Менделеева
(1869 г.)
Свойства простых тел, а также свойства и формы соединений элементов находятся в периодической зависимости от величины атомных весов элементов
современная формулировка
Свойства химических элементов, а также свойства и формы образуемых ими соединений находятся в периодической зависимости от величины заряда их ядер
Физический смысл периодического закона:
за счет периодически повторяющейся конфигурации электронных оболочек атомов происходит периодическое повторение химических свойств их элементов
Элементы располагаются в периодической системе в порядке возрастания заряда их ядер.
Структура периодической системы
(короткая форма)
Периоды – 7 |
Группы – 8 |
(горизонтальные строчки) |
(вертикальные столбцы) |
3с3 |
А подгруппа – главная |
|
В подгруппа – побочная |

Электрон, который последним заполняет орбитали атома, называется
формирующим
Элементы-аналоги – элементы, имеющие одинаковое строение внешних электронных оболочек и расположенные в одной подгруппе.
В ПСЭ различают 4 группы элементов, называемых по формирующему электрону s-, p-, d-, f- элементы
s-элементы |
р-элементы |
d –элементы |
f -элементы |
||
расположены в |
расположены в |
расположены в В |
лантаниды и |
||
1А, 2А |
3А - 8А |
– подгруппах, |
актиниды, их |
||
подгруппах и Н, |
подгруппах, |
их краткая |
краткая |
||
Не, их краткая |
их краткая |
электронная |
электронная |
||
электронная |
электронная |
формула: |
формула: |
||
формула: |
формула: |
|
1 14 |
(n- |
|
ns2np1 6 |
(n-1)d1 10ns2(1) |
(n-2)f |
|||
ns |
1 2 |
1)d0 2ns2 |
|
||
|
|
|
|
|
|
где n –номер периода, в котором находится элемент
(1 2), (1 6) – номер группы, в которой находится элемент
для d –элементов – «проскок электронов» из подуровня ns в (n-1)d
(Cu, Ag, Au, Pt, Pd, Rh, Ru, Cr, Mo, Nb)
Например, для Cu …3d104s1 но не …3d94s2
Это связано с более низкой энергией конфигурации 3d104s1 по сравнению с 3d94s2
При сообщении атому энергии (при столкновении с другим атомом, поглощении кванта света, электронного удара и т.д. один или несколько электронов в атоме, распариваясь, могут перейти на подуровни с более высокой энергией (но только в пределах одного энергетического уровня). Атом становится возбужденным.
Например, |
|
|
B 1s22s22p1 или [He]2s22p1 |
B* 1s22s12p2 |
[He]2s12p2 |

Радиус атомов
За радиус атома принимают теоретически рассчитанное расстояние от ядра до наиболее удаленного максимума электронной плотности.
Впериодах наблюдается тенденция к ↓ радиуса атомов.
Вгруппах с ↑ заряда ядра и ↑ числа электронных слоев радиус атомов увеличивается
Энергия ионизации
I
Энергия, необходимая для удаления электрона от атома
Э - е = Э+
Положительно заряженные ионы – катионы
Впериодах I в основном возрастает
Вгруппах – I несколько уменьшается
Сродство к электрону
Еср
Энергетический эффект присоединения электрона к атому
Э + е = Э-
Отрицательно заряженные ионы – анионы Наибольшее значение Еср имеют галогены, кислород, сера
Электроотрицательность и окислительно – восстановительные свойства элементов
Восстановительная активность элементов определяется способностью атомов отдавать электроны, такие вещества называют
восстановителями
Окислительная способность элементов определяется способностью их атомов присоединять электроны, вещества – окислители
Суммарная способность атомов притягивать электроны называется
электроотрицательность (ЭО)
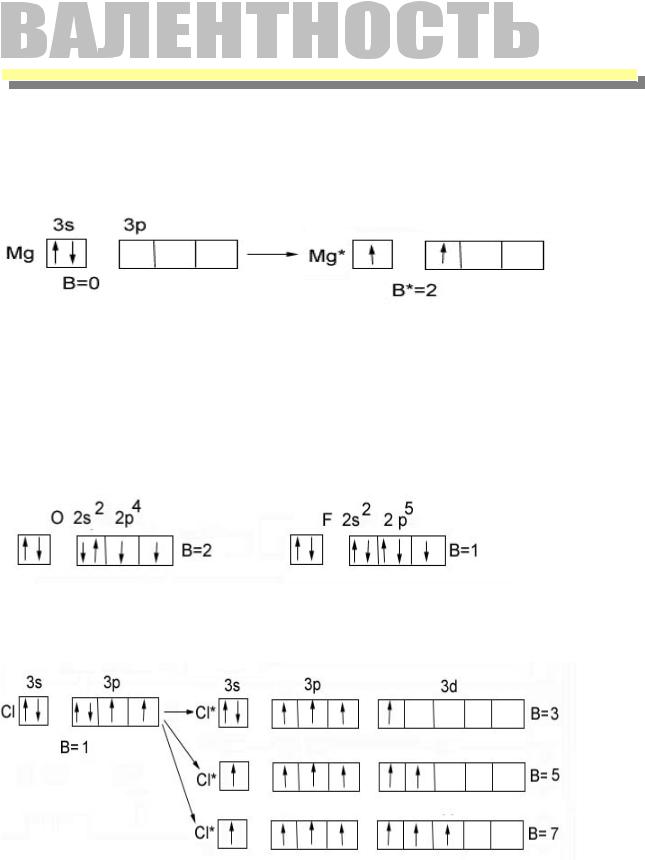
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей.
Количественная мера валентности - число неспаренных электронов в основном или возбужденном состоянии атома.
валентность Мg - в основном состоянии = 0
в возбужденном состоянии = 2
Кислород и фтор – возбужденного состояния нет
Cl– аналог фтора – валентность 1, 3, 5, 7 - наличие свободных d-орбиталей на третьем энергетическом уровне:

валентность Cо: в основном состоянии = 0
в возбужденном состоянии
Для большинства d-элементов валентность в основном состоянии равна 0, т.к. на внешнем уровне нет неспаренных электронов. Например, Fe …3d64s2 В=0
В возбужденном состоянии s-электроны распариваются
Кроме внешних валентными могут быть неспаренные d-электроны предвнешнего подуровня
Валентность Fe* может быть В* = 2, 3, 4, 5, 6
..
