
- •Электронный учебно- методический комплекс
- •Движение электронов в атоме
- •Эрнеест Р еез рфорд
- •1911 г. Планетарная модель атома
- •Спектр излучения атома
- •Каждый атом или молекула может находиться в том
- •Взаимодействие частиц в квантовой механике характеризуют потенциальной энергией, формула которой заимствуется из классической
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Главное квантовое число n может принимать любые целые положительные значения от 1 до
- •С увеличением n расстояние между
- •Спектр излучения атома водорода
- •Орбитальное квантовое число l
- •Число орбиталей на энергетических подуровнях
- •Каждому уровню энергии соответствует стоячая электронная волна, электрон
- •Условное изображение облаков электронной плотности для разных состояний электрона в атоме
- •Магнитное квантовое число
- •Спиновое квантовое число s
- •Слева направо: Джордж Уленбек, Хендрик Крамерс и Сэмюэл Гаудсмит
- •Спин – это одно из проявлений принципа тождественности частиц, который
- •Заполнение электронных состояний в атоме кремния
Главное квантовое число n может принимать любые целые положительные значения от 1 до ∞. Оно определяет величину энергии
En |
|
Z 2 |
q4 |
m |
0 |
|
13,6 |
|
1 |
эВ (1) |
|
|
8 02 h |
2 n2 |
|
||||||||
|
|
|
|
n2 |
|
||||||
|
Rn |
n2 |
0 |
h2 |
|
|
|
|
|||
|
m0 Z q2 |
|
|
|
|||||||
|
|
|
|
|
|
||||||
Здесь Z – порядковый номер элемента в таблице Д.И. Менделеева.

С увеличением n расстояние между
энергетическими уровнями и энергия связи электронов с ядрами уменьшается, значение энергетического зазора между уровнями падает.
Согласно (1), энергия электрона, находящегося в связанном состоянии (например, энергия электрона атома любого вещества), может принимать лишь некоторые дискретные значения, а
все остальные значения невозможны или, как принято говорить, запрещены.
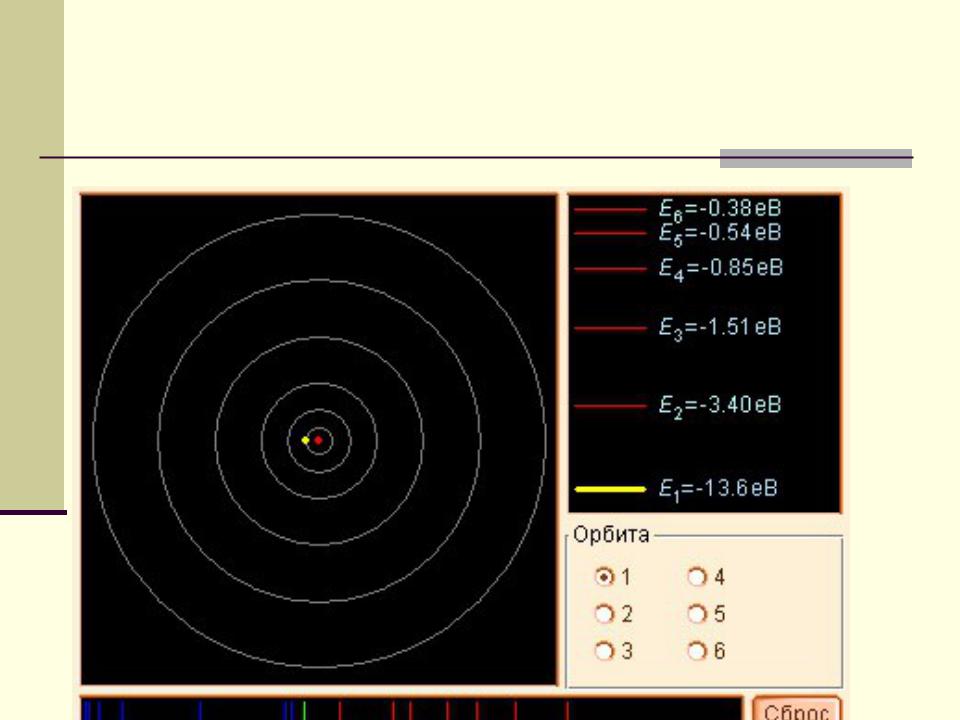
Спектр излучения атома водорода

Орбитальное квантовое число l
определяет форму орбитали. Значение орбитального числа l=(n-1)=0,1,2,3...(n-1).
Также вводят буквенные обозначения: 0-s, 1-p, 2-d, 3-f.

E4 E3
E2
E1
4s, p,d,
3s, p,d
2s, p
En Ryn2
Ry |
m |
|
e2 |
|
|
|
|
|
|
2 |
|
|
||
|
|
|
||
|
2h |
4 0 |
||
1s
Eвак.
f
2

Число орбиталей на энергетических подуровнях
Орбитали с l = 0 называются s- орбиталями,
l = 1 – р-орбиталями (3 типа,
отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов)

Каждому уровню энергии соответствует стоячая электронная волна, электрон
колеблется вокруг и возле атомов и образует как бы облако электронной плотности. Плотность этого облака показывает вероятность обнаружения электрона в той или иной области пространства или долю времени, которую электрон проводит в той или иной области.
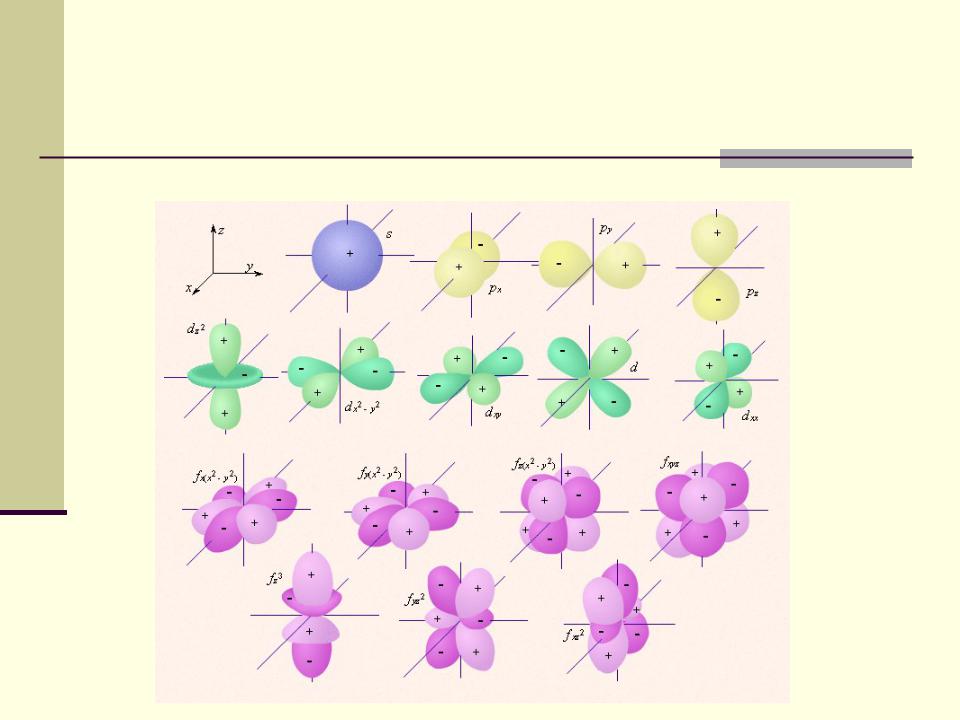
Условное изображение облаков электронной плотности для разных состояний электрона в атоме
водорода

Магнитное квантовое число
характеризует величину магнитного поля, создаваемого при вращении электрона вокруг ядра. Поэтому значение магнитного квантового числа m связано со значением орбитального квантового числа и изменяется от –l до + l, а всего число может принимать (2l+1) значение, включая нулевое.
Например, для l = 2: m = -2, -1, 0, 1, 2.

Спиновое квантовое число s
Электрон помимо координат и импульса характеризуется вектором спина, спин,  подобно заряду, – внутренняя характеристика электрона, в классической
подобно заряду, – внутренняя характеристика электрона, в классической
теории аналогичного понятия быть не может. Спиновое число s =+½.
Внутренний момент импульса, связанный с этим вращением, назвали спином (от англ.
spin – вращение), а момент, связанный с вращением вокруг ядра – орбитальным моментом.
