
- •Электронный учебно- методический комплекс
- •Движение электронов в атоме
- •Эрнеест Р еез рфорд
- •1911 г. Планетарная модель атома
- •Спектр излучения атома
- •Каждый атом или молекула может находиться в том
- •Взаимодействие частиц в квантовой механике характеризуют потенциальной энергией, формула которой заимствуется из классической
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Квантование энергии атома
- •Главное квантовое число n может принимать любые целые положительные значения от 1 до
- •С увеличением n расстояние между
- •Спектр излучения атома водорода
- •Орбитальное квантовое число l
- •Число орбиталей на энергетических подуровнях
- •Каждому уровню энергии соответствует стоячая электронная волна, электрон
- •Условное изображение облаков электронной плотности для разных состояний электрона в атоме
- •Магнитное квантовое число
- •Спиновое квантовое число s
- •Слева направо: Джордж Уленбек, Хендрик Крамерс и Сэмюэл Гаудсмит
- •Спин – это одно из проявлений принципа тождественности частиц, который
- •Заполнение электронных состояний в атоме кремния

Электронный учебно- методический комплекс
Физика конденсированного состояния
Презентации к лекционному курсу
МОСКВА |
2012 |
НИУ «МЭИ» |

Движение электронов в атоме
Все окружающие нас тела состоят из элементарных частиц (атомов) или из групп определенным образом объединенных атомов (молекул). Любая молекула состоит из совокупности электронов и атомных ядер, движение и взаимное расположение которых определяют значение внутренней энергии молекулы

Эрнеест Р еез рфорд
(англ. Ernest Rutherford)
30.08.1871, Спринг Грув - 19.10.1937, Кембридж) – британский физик новозеландского происхождения. Известен как «отец» ядерной физики, создал
планетарную модель атома. Лауреат Нобелевской премии по химии 1908 года.
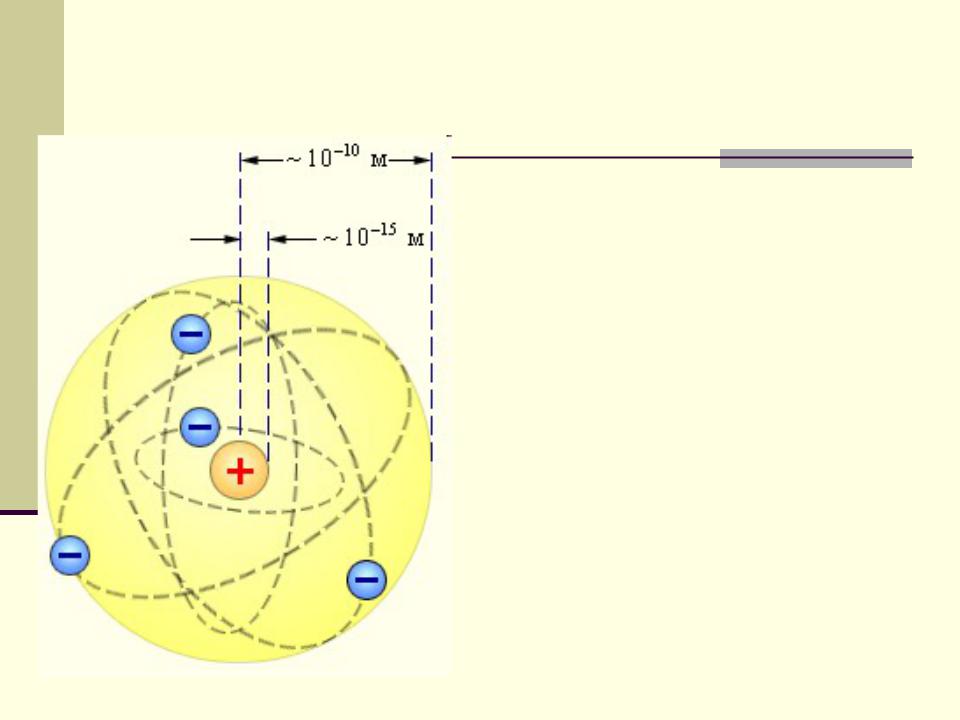
1911 г. Планетарная модель атома
Проблема: электрон движется с ускорением следовательно, излучает, следовательно, теряет энергию следовательно, падает на ядро
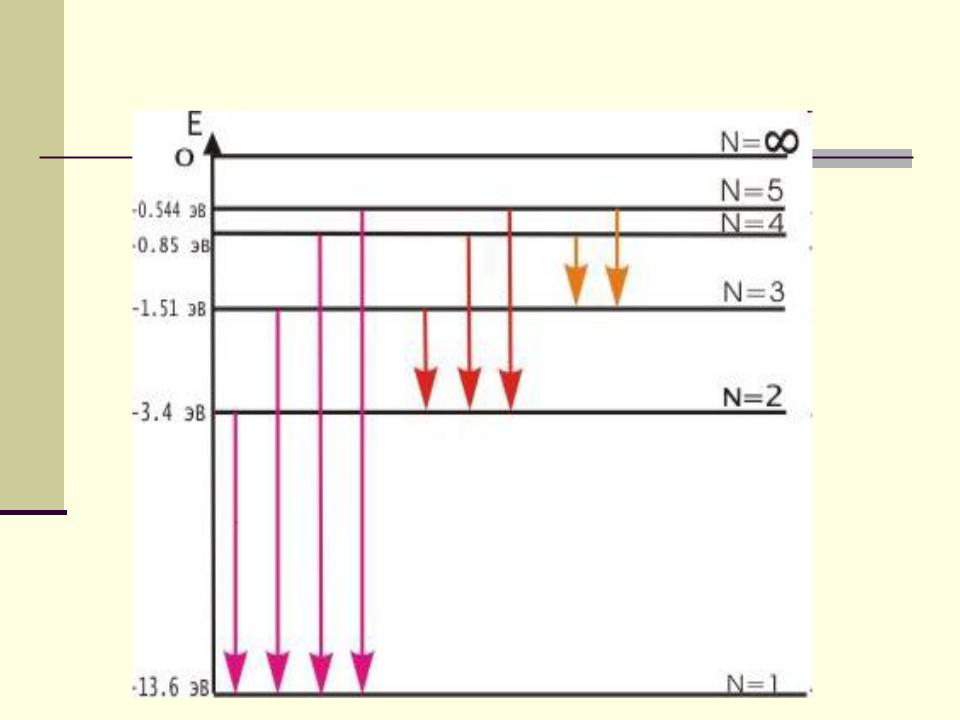
Спектр излучения атома

Каждый атом или молекула может находиться в том
или другом энергетическом состоянии. Иначе говоря, их
внутренняя энергия квантована. Целью теории Бора
было объяснить дискретные уровни энергии в атоме, иными словами, произвести квантование движения в
атоме.
Для описания электронной системы, будь то атом, молекула или кристалл необходимо знать все её
возможные квантовые состояния, характеризуемые энергетическим спектром системы (кристалла, атома).
Если электронная система находится в равновесии и не подвергается никаким внешним воздействием, то находящиеся в ней электроны должны занимать состояния с минимальной энергией.

Взаимодействие частиц в квантовой механике характеризуют потенциальной энергией, формула которой заимствуется из классической механики. Например, потенциальная энергия заряженной частицы (например, электрона с зарядом минус q) в электрическом поле другой заряженной частицы (например, ядра атома водорода c зарядом плюс q)
выражается формулой
Eï U (r) q 4 q2 r
0

Постулаты Бора
Нильс Хеенрик Дав иед Бор
(дат. Niels Henrik David Bohr; 7.10 1885, Копенгаген ‒ 18.11 1962, Копенгаген) ‒ датский физик-теоретик.
Лауреат Нобелевской премии по физике (1922).
Был членом более чем 20 академий наук мира, в том числе иностранным почётным членом АН
СССР

Постулаты Бора
1. Электрон в атоме может двигаться только по определенным стационарным орбитам, каждой из которых можно приписать определенный номер n=1, 2, 3...
Такое движение соответствует стационарному состоянию атома с неизменной полной энергией En. Это означает, что движущийся по стационарной замкнутой орбите электрон, вопреки законам классической электродинамики, не излучает энергии. Стационарное состояние характеризуется определенной энергией и распределением электронной плотности. Совокупность энергий стационарных состояний образует энергетический спектр электрона в атоме

