
лекция2_распылительная сушка
.pdf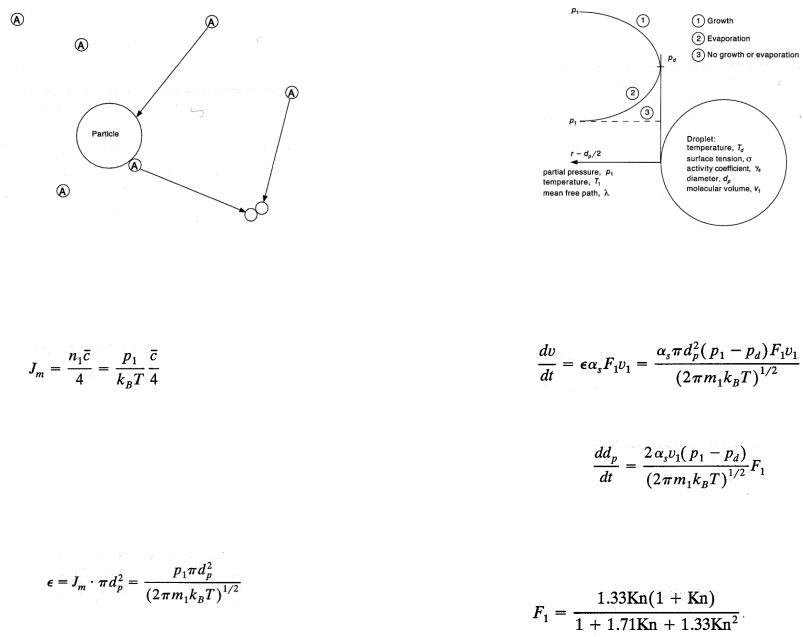
Образование и пост частиц размером меньше свободного пробега молекулы Kn>>1
Для частиц размером порядка 10 нм, молекулы газа ударяют частицу меняя ее направление.
Поток частиц в потоке газа можно описать следующим образом:
Где 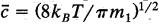 средняя скорость молекул газа,
средняя скорость молекул газа,
n1 – концентрация молекул, p1 – парциальное давление газа
Введя некий коэффициент αs соударения частицы с молекулами того же состава что и частица, учтя процессы осаждения и испарения мы можем вывести изменение размеров частицы во времени
Изменение размера частицы можно определить следующим образом:
Общее количество столкновений молекул с поверхностью частицы определяется следующим соотношением:
Где p1 – парциальное давление газа, pd – парциальное давление частиц или капель, ν1 – объем частицы, m1 – масса молекулы, F1 – корректирующий коэффициент, вычисляемый по формуле:
Рост частиц в режиме непрерывной среды
В условиях когда размер частицы превышает длину свободного пробега молекулы (Kn<<1), процессы испарения и осаждения молекул с поверхности частицы определяются исключительно скоростью диффузии молекул по поверхности частицы
Скорость изменения размеров частицы определяется следующим соотношением:
Где D – коэффициент диффузии, p1 – парциальное давление газа, pd – парциальное давление частиц или капель, ν1 – объем частицы, m1 – масса молекулы, F2 – корректирующий коэффициент, вычисляемый по формуле:
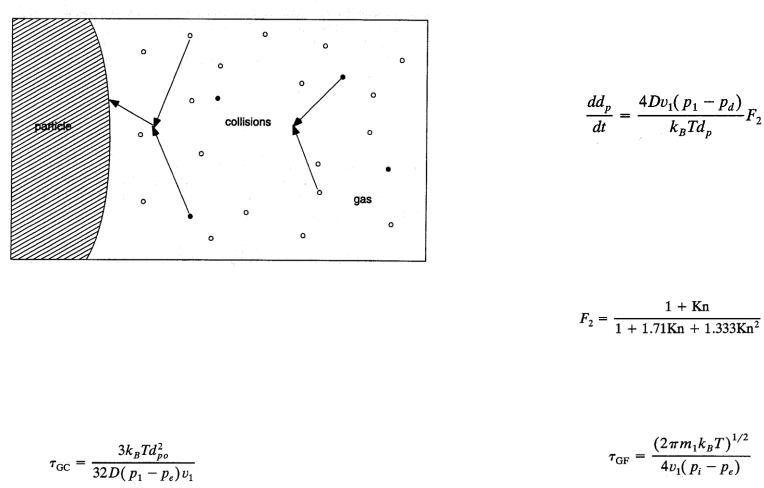
Определение характеристического времени конденсации или испарения
Kn<<1 |
Kn>>1 |
Где dp0 – начальный диаметр частицы, pd = pe
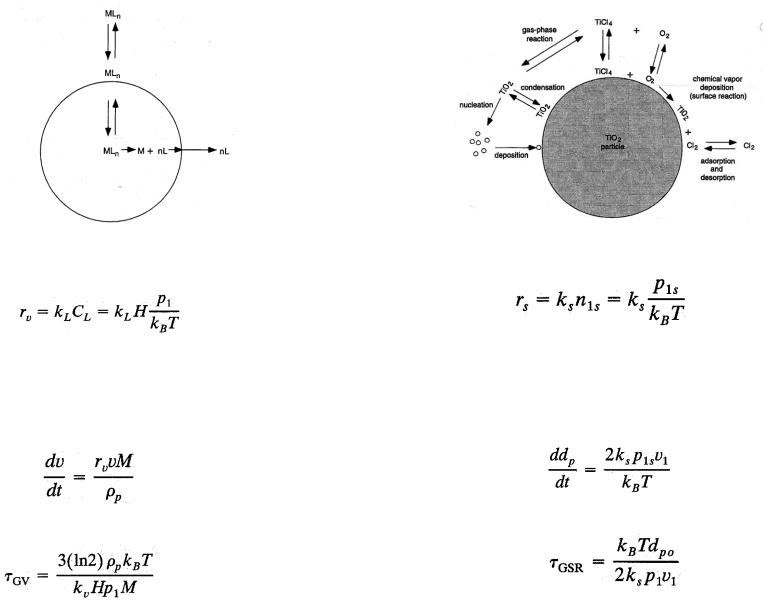
Рост частицы за счет химической реакции
Рост частицы за счет реакции |
Рост частицы за счет реакции протекающей на |
протекающей в объеме частицы |
поверхности частицы |
Рассмотрим случай взаимодействия молекул с неким веществом растворенным в капле жидкости, тогда скорость реакции в капле описывается следующим выражением:
Где H – константа Генри, которая связывает концентрацию (CL) вещества в жидкости с парциальным давлением вещества
Соответственно скорость роста частицы определяется:
Или в упрощенном варианте время необходимое для удвоения размеров частицы:
Скорость реакции для реакции первого порядка описывается следующим образом:
ks – константа реакции
Исходя из скорости реакции, можно определить увеличение размеров молекулы для такой реакции:
Или в упрощенном варианте время необходимое для удвоения размеров частицы:
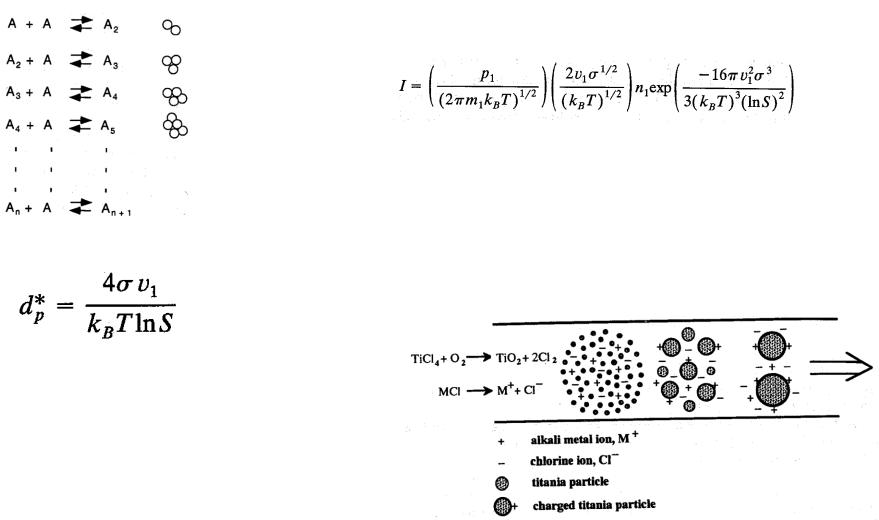
Образование частиц лимитированное скоростью реакции
Визуализация зарождения частицы
Наиболее простая, классическая теория описания скорости зарождения частиц из молекул и их роста до стабильного состояния предлагает следующую зависимость:
Что по сути является обобщением уравнений описывающих скорость роста частицы в режиме свободного пробега молекулы, уравнения описывающего стабильность начального кластера и уравнения Кельвина связывающего зависимости парциального давления на плоской поверхности и изогнутой поверхности для одного вещества.
Уравнение описывает размер стабильного кластера в зависимости от поверхностного натяжения (σ), объема молекулы или атома (ν) и степени насыщения пара (S)
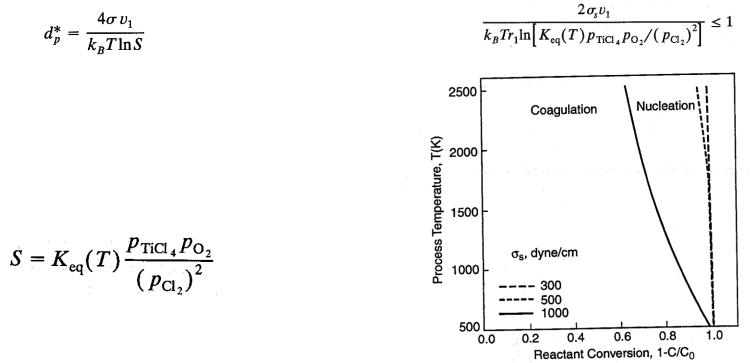
Образование частиц лимитированное процессом диффузии вещества из среды
Реализуется в случае когда нет термодинамического барьера образования частиц, т.е. размер стабильной частицы определяемый уравнением Кельвина меньше размера мономера
Скорость роста частицы определяется подвижностью мономеров (т.е. температурой и вязкостью среды) и их парциальным давлением, которые могут быть объединены как коэффициент насыщения (Пример получения оксида титана).
Заменив это выражение на уравнение Кельвина с тем условием, что размер стабильной частицы меньше мономера получим следующую зависимость
Графическое изображение процесса коагуляции TiO2 в зависимости от температуры и конверсии компонентов (С0 – концентрация TiCl4, С – концентрация TiO2).
