
Thermodynamics
.pdf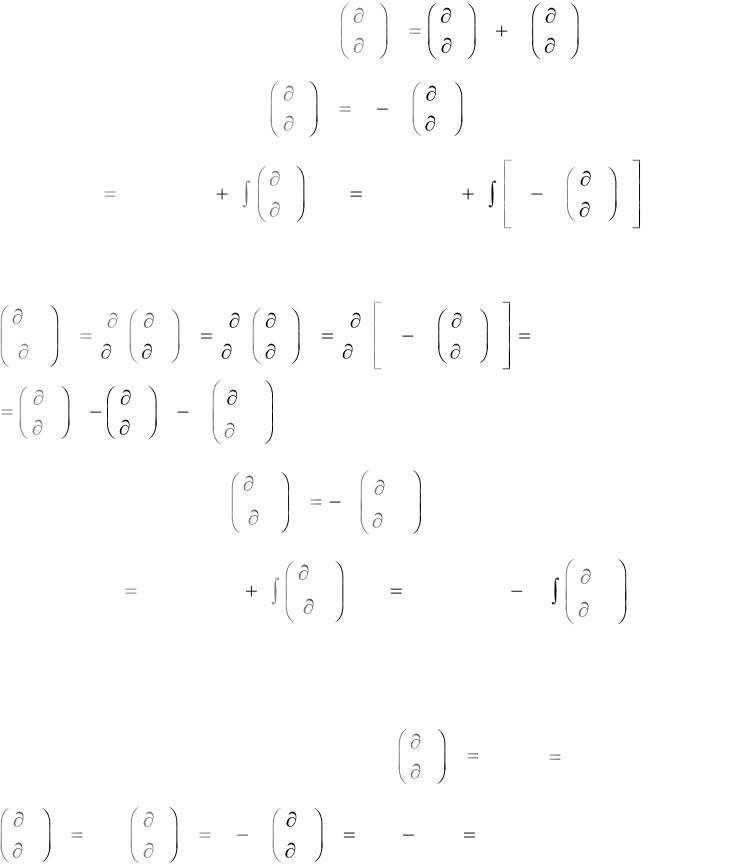
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
121 |
2)h = f(T, p); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
g = h – Ts; h = g + Ts; |
|
h |
|
|
|
|
|
|
|
g |
T |
s |
; |
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
p T |
|
|
|
|
|
|
|
p T |
p |
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
v |
|
T |
|
|
v |
; (*) |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
||||||||||
|
h(T, p) h0(T, p ) |
|
|
p |
|
|
|
|
|
h |
|
|
|
dp h0(T, p ) |
|
|
p |
|
|
|
v |
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v T |
|
|
|
dp ; |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
T |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
p |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|||||||
3)cp = f(T, p); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
cp |
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
v T |
|
|
|
|
v |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
p T |
|
|
p T p |
|
|
T p T |
|
|
|
T |
|
|
|
|
T p |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
v |
|
|
|
|
|
|
v |
|
|
|
|
T |
|
|
2v |
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
T |
|
|
|
|
|
T |
|
|
|
|
|
T |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
p |
|
|
|
p |
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cp |
|
|
|
|
|
|
|
T |
|
2v |
|
|
|
; (*) |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
T |
|
|
|
T |
2 |
|
|
p |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
c |
|
|
(T, p) c |
0(T, p ) |
|
|
|
p |
|
|
|
cp |
|
dp c |
|
0(T, p ) T |
p |
|
2v |
dp ; |
||||||||||||||||||||||||||||||||||||||||
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
p |
|
|
|
|
0 |
|
|
|
T |
2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p0 |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p0 |
|
p |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Задача. Доказать, что h, u, cp, cv |
идеального газа не зависят |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
от давления. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
1) Т.к. h = f(T, p); → доказать, что |
|
|
|
h |
|
|
|
|
0 ; |
v |
|
RT |
; |
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
p |
|
T |
|
|
p |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
v |
|
|
|
|
R |
; |
|
|
|
|
h |
|
v T |
|
|
v |
|
|
|
RT |
|
|
T |
|
R |
0; |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
T p |
p |
|
|
|
|
p T |
|
|
T |
p |
|
|
|
p |
|
|
|
p |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
2) u = h - pv = h - RT = f(T);
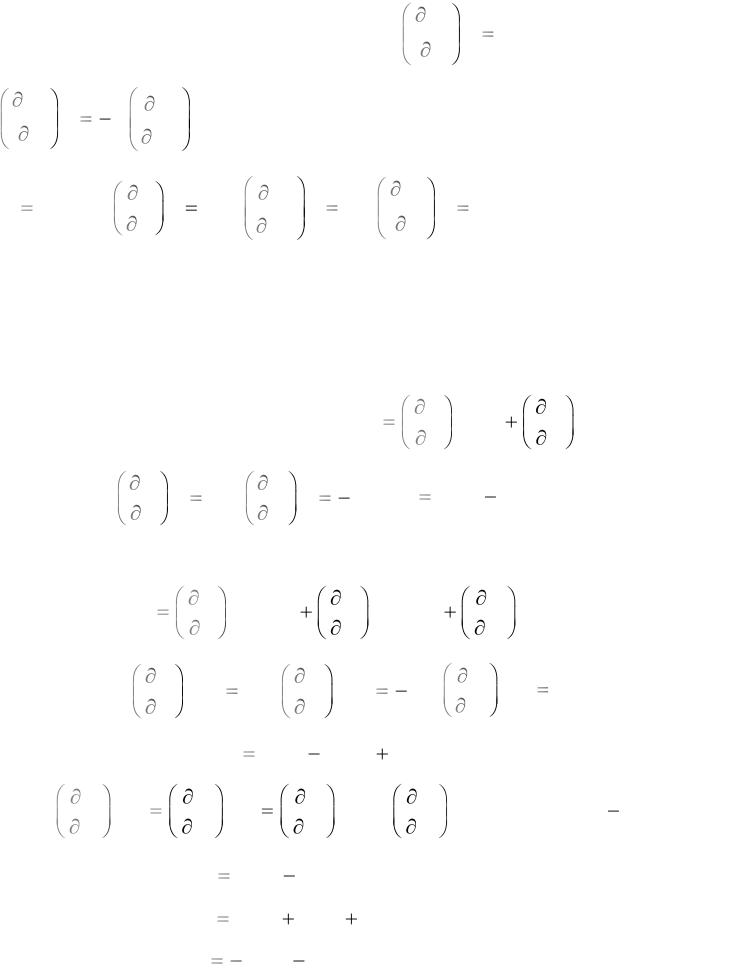
122
3) Т.к. cp = f(T, p); |
→ доказать, что |
cp |
0 ; |
|||||
p |
||||||||
|
|
|
|
|
|
T |
||
|
cp |
T |
2v |
; |
|
|
|
|
|
p |
T 2 |
|
|
|
|||
|
T |
p |
|
|
|
|||
|
|
|
|
|
|
|||
v |
RT |
; |
v |
|
R |
; |
2v |
0 ; |
cp |
0 |
; |
|
p |
T |
p |
p |
T 2 |
p |
|||||||
|
|
|
p |
T |
|
|||||||
|
|
|
|
|
|
|
|
|
4)cv = cp – R = f(T);
10.3.Термодинамические соотношения для систем
спеременной массой
m = const; U = f(S, V); dU |
|
U |
dS |
|
U |
dV ; |
||||
|
|
|
|
|||||||
|
S |
|
V |
|||||||
|
|
|
|
|
|
V |
|
S |
||
|
U |
T ; |
U |
p; |
dU TdS |
pdV ; (*) |
||||
|
|
|
||||||||
|
S |
V |
||||||||
|
V |
S |
|
|
|
|
|
|
||
m ≠ const; U = f(S, V, m);
|
dU |
|
|
U |
dS |
|
|
|
U |
dV |
|
U |
|
dm; |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
S |
|
|
|
V S,m |
|
m |
||||||||||||||
|
|
|
|
|
V,m |
|
|
|
|
|
|
S,V |
||||||||||
|
|
U |
|
|
|
|
|
T ; |
|
U |
|
|
|
|
p; |
U |
|
φ ; |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
S |
|
V,m |
|
|
|
V S,m |
|
|
m S,V |
|||||||||||
|
|
|
|
|
dU TdS |
|
|
pdV φ dm; (**) |
|
|||||||||||||
U |
|
|
H |
|
|
|
F |
|
= |
G |
= |
φ = g = h Ts ; |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
m S,V |
|
|
m S,p |
m T ,V |
m T,p |
|
|
|||||||||||||||
U = f (S, V, m); dU |
TdS |
pdV + φ dm; |
H = f (S, p, m); dH |
TdS |
Vdp φ dm; |
F = f (V, T, m); dF pdV SdT + φ dm;

123
G = f (p, T, m); dG Vdp SdT + φ dm.
124
11.Равновесие термодинамических систем
11.1. Общие условия равновесия термодинамических систем
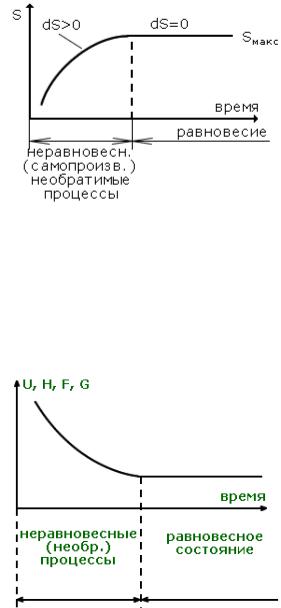
dQ = dU + pdV; dQ = dH - Vdp; TdS ≥ dQ; 1)Для изолированной системы (U = const, V = const)
TdS ≥ dU + pdV; → dS ≥ 0;
-для неравновесных процессов
dS > 0; (направление процесса)
-в равновесном состоянии
S = Smax, dS = 0, d2S < 0. |
Рис. 11.1. |
|
2)Для системы, у которой S = const, V = const
dU ≤ TdS - pdV; → dU ≤ 0;
-для неравновесных процессов
dU < 0; (направление процесса)
-в равновесном состоянии
U = Umin, dU = 0, d2U > 0.
Рис. 11.2.
3)Для системы, у которой S = const, p = const
125
dH ≤ TdS + Vdp; → dH ≤ 0;
- |
для |
неравновесных |
- в равновесном состоянии: |
процессов: |
H = Hmin, dH = 0, d2H > 0. |
||
|
dH < 0; (направление |
|
|
|
|
процесса) |
|
|
|
|
|
|
4)Для системы, у которой V = const, T = const |
||
|
|
dF ≤ - SdT - pdV; → dF ≤ 0; |
|
|
|
|
|
- |
для |
неравновесных |
- в равновесном состоянии |
процессов |
F = F ; dF = 0; d2F > 0. |
||
|
|
|
min |
|
dF < 0; (направление |
|
|
|
|
процесса) |
|
|
|
|
|
|
5)Для системы, у которой p = const, T = const |
||
|
|
dG ≤ - SdT - pdV; → dG ≤ 0; |
|
|
|
|
|
- |
для |
неравновесных |
- в равновесном состоянии |
процессов |
G = G , dG = 0, d2G > 0. |
||
|
|
|
min |
|
dG < 0; (направление |
|
|
|
|
процесса) |
|
|
|
|
|
11.2. Условия равновесия изолированной системы
dS = 0;
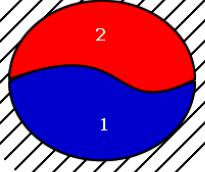
V = V1 + V2 = const; dV1+ dV2 = 0; dV2 = - dV1;
U = U1 + U2 = const; dU1+ dU2 = 0; dU2 = - dU1;
Рис. 11.3. |
S = S1 |
+ S2; dS = dS1+ dS2 |
= 0; |
|
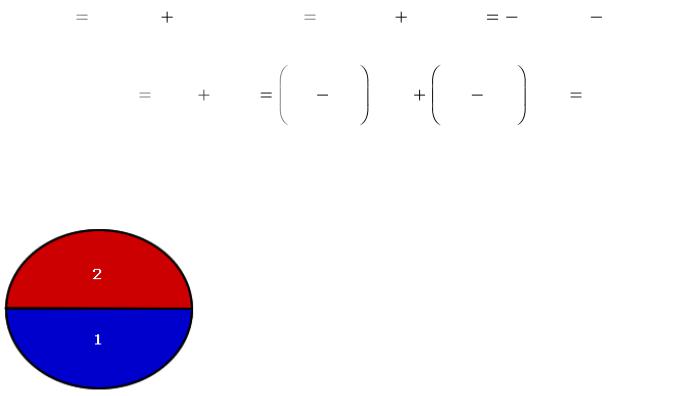
126
dS |
1 |
dU |
p1 dV ; |
dS |
|
1 |
dU |
p2 dV |
|
1 |
dU |
p2 |
dV ; |
||||
|
|
|
|
|
|
||||||||||||
1 |
1 |
T1 |
1 |
2 |
2 |
2 |
1 |
1 |
|||||||||
|
T1 |
|
|
|
T2 |
T2 |
T2 |
T2 |
|||||||||
|
dS dS dS |
1 |
|
|
1 |
dU |
p1 |
p2 dV 0 ; |
|||||||||
|
|
|
|
|
|||||||||||||
|
|
|
1 |
2 |
T1 |
1 |
T1 |
1 |
|
|
|||||||
|
|
|
|
|
|
T2 |
T2 |
|
|
||||||||
T1 = T2; p1 = p2;
11.3. Условия фазового равновесия
p = const, T = const → dG ≤ 0;
G = G1 + G2; dG = dG1+ dG2 ≤ 0; m = m1 + m2 = const;
dm1+ dm2 = 0; dm2 = –dm1;
Рис. 11.4.
dG1 = V1dp – S1dT + φ1dm1; dG2 = V2dp – S2dT + φ2dm2;
dG = dG1 + dG2 = φ1dm1 + φ2dm2 = (φ1 – φ2)dm1 ≤ 0.
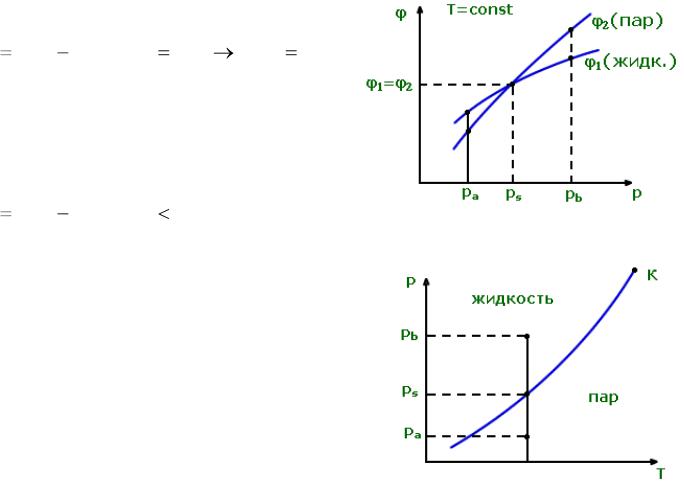
127
В состоянии равновесия
dG (φ1 φ 2 )dm1 0; |
φ1 φ 2; |
Правило 1
В неравновесных состояниях
dG (φ1 |
φ 2 )dm1 0 ; |
|
Рис. 11.5. |
|
|
|
|
а) если |
φ1 > φ2, то |
dm1 < 0, |
а |
dm2 > 0; → испарение; |
|
|
|
б) если |
φ1 < φ2, то |
dm1 > 0, |
а |
dm2 < 0;→ конденсация; |
|
||
Правило 2
Рис. 11.6.
128
12. Термические уравнения состояния
реального газа
12.1. Уравнение Ван-дер Ваальса (1873 г.)
p |
RT → p |
RT |
|
a |
; |
p |
a |
v b RT ; |
|
v b |
v2 |
v2 |
|||||||
|
v |
|
|
|
|||||
|
|
a = const; b = const. |
|
||||||
Смысл коэффициентов а и b. |
|
|
|
|
|||||
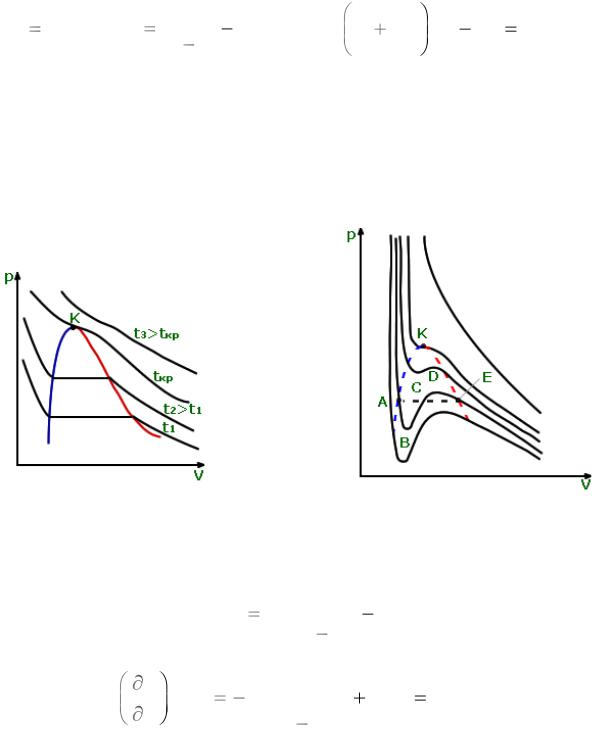
Изотермы Эндрюса |
|
|
|
Изотермы Ван-дер-Ваальса |
|||||
Рис. 12.1. |
|
|
|
|
|
Рис. 12.2. |
|
|
|
|
|
|
|
Корни уравнения |
|
|
|
|
|
|
Для критической точки: |
p |
RTкр |
|
a |
; |
|
|
|
|
|
|||
|
|
|
|
|||
|
кр |
vкр |
b |
vкр2 |
|
|
|
|
|
||||
p |
|
RTкр |
|
|
2a |
0 |
; |
|
v T ,кр |
vкр b |
2 |
v3 |
|||||
|
|
|||||||
|
|
|
|
кр |
|
|
||
129
|
|
|
2 p |
|
|
|
2RTкр |
|
|
|
6a |
|
0 |
; |
|||||
|
|
|
v2 |
T ,кр |
|
vкр |
b |
3 |
v4 |
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
кр |
|
|
||||||||
|
|
p |
|
|
a |
; T |
|
|
8a |
; |
v |
|
3b; |
||||||
|
|
|
|
|
|
|
|
кр |
|||||||||||
|
|
|
кр |
|
27b2 |
|
кр |
|
27bR |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
zкр |
pкрvкр |
0,375 |
. У реальных газов zкр = 0,22 – 0,33. |
||||||||||||||||
RTкр |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||||||||||||||||
Определение констант а и b |
|
|
ркр, Ткр → а1 и b1; |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ркр, vкр → а2 и b2; |
||||||||
|
|
|
|
|
|
|
|
|
|
|
vкр, Ткр → а3 и b3; |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Правило Максвелла |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
Цикл ABCDEA → lц = 0. |
|||||||||||||
|
|
|
|
|
|
По второму закону lц |
pdv 0 ; |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ABCDEA |
|
lц = lц1 + lц2 = 0; lц1 > 0; lц2 < 0;
пл. A-B-C-A = пл. С-D-E-C;
Рис. 12.3.
Метастабильные состояния: AB – перегретая жидкость; ED – переохлажденный пар;
BD – физически нереализуемые состояния (т.к. (∂р/∂v)T > 0).
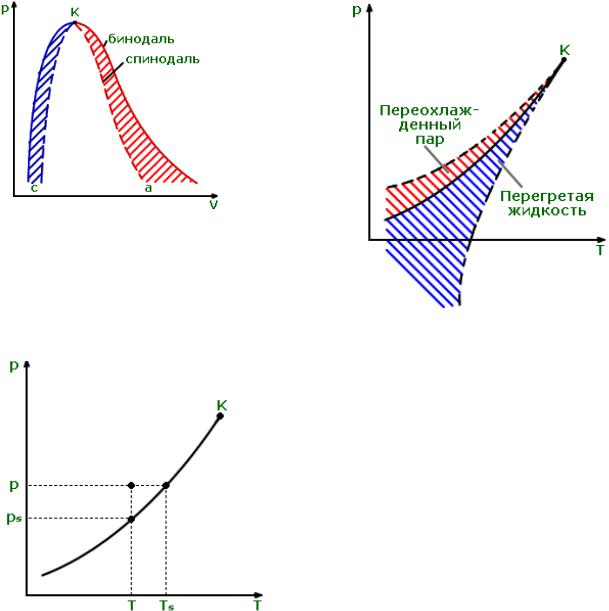
130
Рис. 12.4.
Рис. 12.5.
∆T = Ts – T; – переохлаждение. s = p / ps; – пересыщение.
Рис. 12.5а.
